-
下列不是大气污染指标的是
A. 氮氧化合物 B. 二氧化碳 C. 悬浮颗粒 D. 二氧化硫
难度: 简单查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
C. 大量燃烧化石燃料排放的废气中含SO2,造成大气污染,使雨水pH=5.6 形成酸雨
D. 利用铝制容器盛装浓硫酸的原因不是浓硫酸跟铝不反应,而是发生钝化
难度: 中等查看答案及解析
-
对于下列实验现象描述错误的是
A.钠在氧气中燃烧生成淡黄色固体
B.镁在二氧化碳中燃烧生成白色固体和黑色颗粒
C.将过量的NaOH溶液逐滴滴入AlCl3溶液中先无明显现象后出现白色絮状沉淀
D.将过量的稀盐酸逐滴滴入稀Na2CO3溶液中,开始几乎不会产生气体,后来出现大量气体。
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 活性炭具有还原性,可用作冰箱除味剂
B. 二氧化硫具有氧化性,可用作造纸票白剂
C. A12O3具有很高的熔点,可用于制造熔融烧破的坩埚
D. Fe3+具有氧化性,可用于蚀刻印刷电路铜板
难度: 中等查看答案及解析
-
实验室中有关试剂的保存方法错误的是 ( )
A. 少量金属钠保存在煤油当中 B. 少量白磷保存在水中
C. 烧碱溶液保存在带玻璃塞的试剂瓶中 D. 氢氟酸保存在塑料瓶中
难度: 中等查看答案及解析
-
将铁放入下列溶液中,铁溶解而溶液质量减轻的是
A. FeCl2溶液 B. 稀H2SO4
C. 热的NaOH溶液 D. CuSO4溶液
难度: 中等查看答案及解析
-
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置.下列各图中能用作防倒吸安全瓶的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列化合物:①Na2O2、 ②Fe(OH)3 、③FeCl2、④CuS、⑤H2SiO3、⑥NaHCO3,其中不能通过化合反应制得的有几项?
A. 一项 B. 二项 C. 三项 D. 四项
难度: 中等查看答案及解析
-
如图A处通入Cl2,当关闭B阀时,C处湿润的红布条没有明显变化,当打开B阀时,C处的湿润红布条逐渐褪色。则D瓶中装的溶液是

A. 浓H2SO4 B. 饱和食盐水 C. 水 D. NaOH溶液
难度: 简单查看答案及解析
-
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃
⑤制取蒸馏水时,先通冷却水,后加热烧瓶
⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体
A. ①②③④ B. ①②③④⑤ C. ①②③④⑥ D. 全部
难度: 困难查看答案及解析
-
下列实验操作或结论正确的是
A. 配制溶液的操作中,转移溶液后,玻璃棒、烧杯未洗涤会使得所配熔液浓度偏高
B. 洗涤沉淀的操作是将沉淀置于过滤器中,边用玻璃棒搅拌边加蒸馏水冲洗
C. 制备Fe (OH)3胶体时,将饱和FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液
D. 实验室配制950 mL 0.2 mol/L 的CuSO4溶液时,需称取胆矾质量为50.0 g
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 硅的化学性质不活泼,在常温下只与Cl2、F2、HF、强碱反应
B. SiO2是酸性氧化物,所以不与任何酸反应
C. .陶瓷、水泥以及玻璃都是硅酸盐产品,都属于传统的无机非金属材料
D. 因为CaCO3+SiO2=CaSiO3+CO2 ↑,所以硅酸的酸性比碳酸强
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 78g Na2O2固体中阴离子的个数为2NA
B. 标准状况下,1.12L氯气与H2O反应,反应中转移的电子数为0.1NA
C. 60g SiO2含有的化学键数目为4NA
D. CO2通过Na2O2使其增重ag时,反应中转移的电子数为aNA/56
难度: 中等查看答案及解析
-
美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,获得了2010 年诺贝尔化学奖。钯的化合物PdC12通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有:CO、Pd、H2O、HC1、PaCl2和一种未知物质X。下列说法不正确的是
A. 反应中转移的电子为1mol 时,生成2 mol 物质X
B. 未知物质X为CO2
C. 反应中CO 作还原剂
D. 题述反应条件下还原性:CO>Pd
难度: 中等查看答案及解析
-
将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
难度: 中等查看答案及解析
-
下列实验操作及现象与预期实验目的或实验结论正确的是
选项
实验操作及现象
实验目的或结论
A
向硅酸钠溶液中滴加盐酸,用激光笔照射,有丁达尔现象
说明有硅酸胶体生成
B
向纯碱中滴加足量浓盐酸,将产生的气体通入硅酸钠溶液,熔液变浑浊
酸性:盐酸>碳酸>硅酸
C
取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色
该Fe(NO3)2试样已经变质
D
将SO2气体通入高锰酸钾溶液中,紫色褪去
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知 Fe3O4可以表示成 FeO·Fe2O3。 水热法制备 Fe3O4纳米颗粒的反应为:
3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2H2O, 下列说法正确的是( )
A. Fe2+是还原剂, S2O32-和 O2是氧化剂
B. 每生成 1 mol Fe3O4反应转移的电子数为 2 mol
C. 若有 2mol Fe2+被氧化,被 Fe2+还原的 O2为 0.5mol
D. 将纳米 Fe3O4分散在水中 Fe3O4不能透过滤纸
难度: 中等查看答案及解析
-
下列各组物质中,存在X→Y 或Y→Z不能通过一步反应完成转化的一组是
选项
X
Y
Z
A
Al
NaAlO2
Al(OH)3
B
S
SO3
H2SO4
C
H2O
Fe3O4
Fe
D
NaOH
Na2CO3
NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中共存的是
A. 所含溶质为NaHSO4 的溶液:加入K+、CO32-、NO3-、Na+
B. 滴加酚酞变红的溶液: 加入SO42-、Cu2+、K+、Cl-
C. 含有大量SO42-的溶液:加入K+、Cu2+、Cl-、NO3-
D. 常温下,加入铁粉能生成H2 的溶液:加入Na+、Ca2+、C1-、HCO3-
难度: 中等查看答案及解析
-
将少量SO2 气体通入BaC12和FeC13的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
A. 该实验表明SO2有漂白性 B. 白色沉淀为BaSO3
C. 该实验表明FeC13有还原性 D. 反应后溶液酸性增强
难度: 中等查看答案及解析
-
下列实验过程中没有沉淀出现的是
A. 向常温时的饱和碳酸钠溶液中通入足量CO2气体 B. 向硅酸钠溶液中通入氯化氢气体
C. 向氯化钙溶液中通入SO2气体 D. 向次氯酸钙溶液中通入CO2气体
难度: 简单查看答案及解析
-
下列示意图与对应的反应情况符合的是
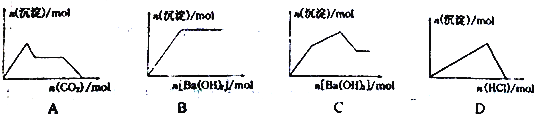
A. 向含0.01mol KOH 和0.01mo1Ca(OH)2 的混合溶液中缓慢通入CO2 至过量
B. 向NaHSO4 溶液中逐滴加入Ba (OH)2 溶液至过量
C. 向KAl (SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向NaAlO2 溶液中逐滴加入盐酸至过量
难度: 中等查看答案及解析
-
下列各组会出现先产生沉淀,然后沉淀再溶解的现象的是
A. 向NaOH溶液中逐滴滴入Al2(SO4)3溶液至过量
B. 向NaAlO2溶液中通入CO2气体至过量
C. 向NaHCO3溶液中逐滴滴入NaOH溶液至过量
D. 向NaAlO2溶液中逐滴滴入盐酸至过量
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子。若向其中加入过氧化钠粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.CO32-、NO3- B.NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
难度: 中等查看答案及解析
-
混合下列各组物质使之充分反应,加热蒸干产物并高温下灼烧至质量不变,最终残留固体为纯净物的是
A. 向CuSO4溶液中加入适量铁粉
B. 等物质的量浓度、等体积的FeCl3与KI溶液混合
C. 等物质的量的NaHCO3与Na2O2溶于水
D. 在Na2SiO3溶液中通入过量CO2气体
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A. .硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-==H2O +BaSO4↓
B. 向NaAlO2溶液中滴加NaHCO3溶液:A1O2-+HCO3-+H2O=Al (OH)3↓+CO32-
C. 向Na2SiO3溶液中通入过量CO2: SiO32-+CO2+H2O=H2SiO3↓+CO32-
D. 向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O= A1O2- +4NH4++2H2O
难度: 中等查看答案及解析
-
下列制取Cl2,用其氧化含I-废液,回收并提纯I2的装置和原理能达到实验目的的是
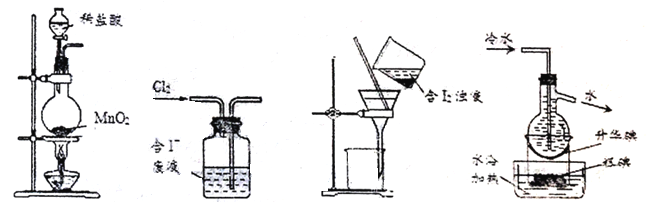
A. 制取Cl2 B. 氧化碘离子 C. 过滤出粗碘 D. 升华提纯碘
难度: 中等查看答案及解析
-
取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到固体X和滤液Y。下列叙述正确的是
A.上述四种氧化物中,至少有三种是碱性氧化物
B.将固体X加入氢氟酸中,X会溶解
C.滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种
D.滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
难度: 中等查看答案及解析
-
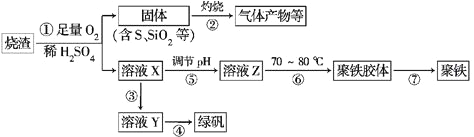
有关下列流程的判州断正确的是

A. 流程中涉及的反应均为非氧化还原反应
B. 反应②产生的阴离子主要为CO32-
C. 反应③在实验室中应在蒸发皿中进行
D. 反应④的条件是对熔融状态下的反应物进行电解
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是 ( )
选项化合物
A
B
C
D
Y
CO2
Fe2O3
SiO2
FeCl3
W
MgO
Al2O3
CO
CuCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程
式为:2MnO4-+16H++ 5Na2O2="===" 2Mn2++5O2↑ + 8H2O + 10Na+ 下列判断正确的是:
A. 高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
B. 反应的氧化产物只有氧气
C. 当反应产生标准状况下2.24 L O2时,反应转移的电子为0.1mol
D. 通常所说的酸化的高锰酸钾溶液是指滴加了浓盐酸的高锰酸钾溶液
难度: 中等查看答案及解析
-
Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
难度: 困难查看答案及解析
-
铁酸盐MFe2O4与H2在高温下反应生成新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均显+2价)。已知铁酸盐MFe2O4被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2:1。则下列说法中不正确的是
A. MFe2Ox是还原产物
B. MFe2Ox 中的+2价铁和+3价铁的物质的量之比为1:3
C. x=3.5
D. 若反应中消耗H2(标准状况下)33.6L,则转移的电子为3mol
难度: 中等查看答案及解析
-
在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式如下:
2 ICl +2 Zn = ZnCl2+ZnI2 ICl+H2O = HCl+HIO
下列关于ICl性质的叙述正确的是( )
A.ZnCl2是氧化产物,又是还原产物
B.ZnI2是氧化产物,又是还原产物
C.ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂
D.ICl跟H2O的反应,是自身氧化还原反应
难度: 中等查看答案及解析
-
w g铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为w g.求原混合物中铝粉的质量分数是
A. 30% B. 50% C. 70% D. 90%
难度: 困难查看答案及解析