-
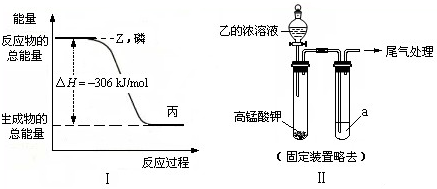
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
序号 甲 乙 丙 ① CO2 SO2 石灰水 ② HCl CO2 石灰水 ③ CO2 SO2 Ba(NO3)2 ④ NO2 SO2 BaCl2 ⑤ CO2 NH3 CaCl2
A.②③④
B.②③④⑤
C.①③④
D.①②③④难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-难度: 中等查看答案及解析
-
室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是( )
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
C.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:C(B+)>C(A-)>C(H+)>C(OH-)难度: 中等查看答案及解析
-
下列说法中不正确的有( )
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②光照氯水有气泡逸出,该气体是Cl2;
③燃煤时加入适量石灰石,可减少废气中SO2的量;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化.
⑥氯气易液化,液氯可以保存在钢瓶中;
⑦常温下浓硫酸可以用铝制容器盛放;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤.
A.2个
B.3个
C.4个
D.5个难度: 中等查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.1molNH4NO3晶体中含有NH4+数为NA个
B.1molC20H42分子中含有的共价键数目为62NA
C.电解精炼铜过程中,电路中每通过NA个电子,阳极溶解铜32g
D.标准状况下,2.24LCCl4和CH2O的混合物中含有NA个碳原子难度: 中等查看答案及解析
-
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g)⇌Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
A.该反应的化学方程式是2HF⇌(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低难度: 中等查看答案及解析
-
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、d、c、e
B.e、b、a、d、c
C.b、a、e、d、c
D.c、d、e、a、b难度: 中等查看答案及解析
-
下列实验室除杂(括号内为少量杂质)的方案正确的是( )
提纯物质 除杂试剂 提纯方法 A 苯(苯酚) 碳酸钠溶液 过滤 B Al(Fe) 氢氧化钠溶液 过滤 C CO2(NO2) 水 洗气 D 乙酸乙酯(乙醇) 水 水洗、分液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.在由水电离出的c(OH-)═10-13mol/L的溶液中:Na+、Ba2+、ClO-、NO3-
B.能使广泛pH试纸显蓝紫色的溶液:K+、Ba2+、Cl-、Br-
C.常温下c(H+)/c(OH-)=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-难度: 中等查看答案及解析
-
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol/L
C.pH=3的NaHA水溶液中,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是( )
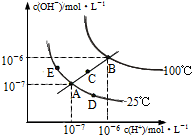
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性难度: 中等查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是( )
A.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度可能是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)═c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)═2c(H+)+c(HA)-c(A-)难度: 中等查看答案及解析
-
向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下,发生下列反应:A(g)+B(g)⇌xC(g)△H<O.测得两容器中c(A)随时间t的变化如图所示:
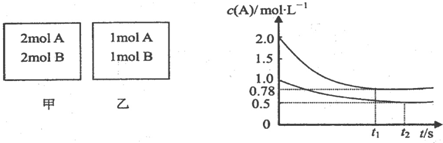
下列说法正确的是( )
A.x可能等于1也可能等于2
B.向平衡后的乙容器中充入氮气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.向甲容器中再充入2mol A、2mol B,平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L难度: 中等查看答案及解析
-
某无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成.向溶液中加入烧碱溶液出现白色沉淀,另取溶液加入稀硫酸也出现白色沉淀并放出气体.据此分析,下列判断中正确的是( )
①肯定有BaCl2; ②肯定有MgCl2; ③肯定有NaHCO3; ④肯定有Na2CO3或NaHCO3; ⑤肯定没有MgCl2.
A.①②③
B.②④
C.①③
D.①③⑤难度: 中等查看答案及解析
-
在其他条件不变时,改变某一条件对A:(g)+3B(g)═2AB3,(g) 化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度).下列结论正确的是( )
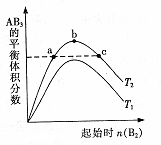
A.a、c两点A2的转化率相等
B.正反应一定是吸热反应,且T2>T1
C.b点时,平衡体系中A、B原子数之比最接近于1:3
D.向a点的平衡体系中加入A2,可达到b点的平衡状态难度: 中等查看答案及解析
-
将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2mol•L-1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( )
A.稀硝酸的浓度为1.9 mol/L
B.生成的NO在标况下的体积为0.896 L
C.a的值为15 mL
D.Cu的物质的量为0.02 mol难度: 中等查看答案及解析
-
下列各组数据关系中,前者比后者大的是( )
A.纯水100℃和25℃时的pH
B.Na2CO3溶液中的HCO3-和OH-数目
C.常温下pH相同的KOH溶液和CH3COOK溶液中由水电离出的OH-离子浓度
D.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目难度: 中等查看答案及解析