-
下列反应中,熵减小的是( )
A、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) B、2N2O5(g)=4NO2(g)+O2(g)
C、 MgCO3(s)=MgO(s)+CO2(g) D、2CO(g)=2C(s)+O2(g)
难度: 简单查看答案及解析
-
已知在298K时下述反应的有关数据:
C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ/mol
C(s)+O2(g)=CO2(g), △H 2= -393.5kJ/mol
则C(s)+CO2(g)=2CO(g) 的△H ( )
A.283.5kJ/mo B 172.5kJ/mol C -172.5kJ/mol D.-504 kJ/mol
难度: 简单查看答案及解析
-
用惰性电极分别电解下列物质的水溶液一段时间后,溶液的pH会下降
的是 ( )
A. BaCl2 B. CuSO4 C .NaCl D. Na2SO4
难度: 简单查看答案及解析
-
用惰性电极电解CuSO4溶液一段时间后,欲使溶液恰好恢复至电解前情
况,可加入的物质是 ( )
A. CuSO4 B. Cu(OH)2 C. Cu D. CuO
难度: 简单查看答案及解析
-
反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速
率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上
等于速率常数。下列说法正确的是( )
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
难度: 简单查看答案及解析
-
用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别
析出的物质是 ( )
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
难度: 简单查看答案及解析
-
在铁制品上镀一定厚度的锌层,以下设计方案正确的是 ( )
A.锌作阳极,铁制品作阴极,溶液中含有锌离子
B.锌作阴极,铁制品作阳极,溶液中含有锌离子
C.锌作阳极,铁制品作阴极,溶液中含有亚铁离子
D.锌作阴极,铁制品作阳极,溶液中含有亚铁
难度: 简单查看答案及解析
-
家用炒菜铁锅用水清洗后,放置一会出现红棕色的铁锈,在此变化过程中不会发生的化学变化是( )
A.2Fe+ O2 + 2H2O=2Fe(OH)2 B.4Fe(OH)2+O2 +2H2O=4Fe(OH)3
C.O2 + 2H2O + 4e- → 4OH- D.Fe → Fe3++3e-
难度: 简单查看答案及解析
-
仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 ( )
A.加热 B.加压 C.加负催化剂 D.加大反应物浓度
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是 ( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
难度: 简单查看答案及解析
-
用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是 ( )
A.2H++2e-=H2↑ B.Zn-2e-=Zn2+
C.2H2O+O2+4e-=4OH- D.Ag++e-=Ag
难度: 简单查看答案及解析
-
将Al片和Cu片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池。则在两个原电池中正极分别为:( )
A、Al片、Al片; B、Cu片、Al片; C、Al片、Cu片; D、Cu片、Cu片
难度: 简单查看答案及解析
-
A、B、C是三种金属,根据下列①、②两个实验:①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。确定它们的还原性强弱顺序为 ( )
A.A>B>C B.B>C>A C.C>A>B D.B>A>C
难度: 简单查看答案及解析
-
常用的钮扣式银锌电池,放电时的电极反应式分别为:
Zn极:Zn+2OH--2e- →Zn(OH)2 Ag2O极:Ag2O+H2O+2e- →2Ag+2OH-
则下列说法中不正确的是( )
A、放电过程中OH-物质的量不变 B、Zn为负极而Ag2O为正极
C、电解质溶液呈碱性 D、电子从Ag2O流出经用电器流入Zn极
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是( )
A、v(A)=0.5 mol·L-1·s-1 B、v(B)=0.3 mol·L-1·s-1
C、v(C)=0.8 mol·L-1·s-1 D、v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
镍-镉(Ni—Cd)可充电电池,可以发生如下反应:
Cd(OH)2 +2Ni(OH)2
Cd+2NiO(OH)+2H2O 由此可知,该电
池的负极材料是 ( )
A. Cd B. NiO(OH) C. Cd(OH)2 D. Ni(OH)2
难度: 简单查看答案及解析
-
如图所示,装置中都盛有0.1mol/L 的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是 ( )
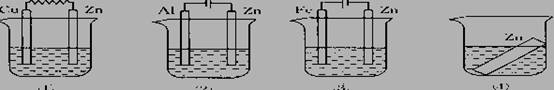
A.①②③④ B.①②④③ C.③①④② D.②①④③
难度: 简单查看答案及解析
-
C+CO2
2CO;ΔH1>0,反应速率v1,N2+3H2
2NH3;ΔH2<0,反应速率v2。如升温,v1和v2的变化是 ( )
A.同时增大 B.同时减少 C.v1增大,v2减少 D.v1减少,v2增大
难度: 简单查看答案及解析
-
对于在一密闭容器中进行的下列反应:C(s)+ O2(g)
CO2(g)下列说法中错误的是 ( )
A.将木炭粉碎成粉末状可以加快化学反应速
B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率
D.增加木炭的量可以加快化学反应速率
难度: 简单查看答案及解析
-
电解CuCl2溶液时,如果阴极上有1.6g铜析出时,则阳极上产生气体的体积是( )
A.0.28L B.0.56L C.0.14L D.11.2L
难度: 简单查看答案及解析
