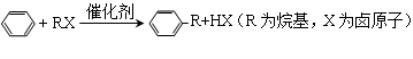-
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染
难度: 中等查看答案及解析
-
下列各项中表达正确的是
A.H2O2的电子式:
B.
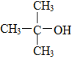 的命名:2,2—二甲基—2—乙醇
的命名:2,2—二甲基—2—乙醇C.常温下,浓度都为0.1mol·Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者
D.
为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键,是极性分子
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是
A.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl
B.热稳定性:HF>H2O>NH3
C.还原性:HF>HCl>HBr>HI
D.水溶性: HCl>H2S> SO2
难度: 中等查看答案及解析
-
不能作为判断硫、氯两种元素非金属性强弱的依据是
A.单质沸点的高低
B.单质氧化性的强弱
C.单质与氢气化合的难易
D.最高价氧化物对应的水化物酸性的强弱
难度: 中等查看答案及解析
-
其他条件不变,升高温度下列数据一定增大的是
A.碱在水中的溶解度
B.乙酸溶液的pH
C.合成氨的反应热
D.醋酸钠溶液中的氢氧根离子浓度
难度: 中等查看答案及解析
-
研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法不正确的是
A.羰基硫分子为非极性分子
B.羰基硫的电子式为:
C.羰基硫沸点比CO2高
D.羰基硫分子中三个原子处于同一直线上
难度: 中等查看答案及解析
-
检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是
A.NaOH B.KMnO4 C.KSCN D.苯酚
难度: 中等查看答案及解析
-
下列各反应中,水既不是氧化剂,又不是还原剂,且反应属于氧化还原反应的是
A.氟气和水 B.铝与氢氧化钠溶液
C.二氧化氮和水 D.五氧化二磷与冷水
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
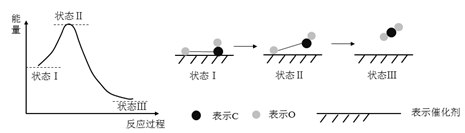
下列说法正确的是
A.在该过程中,CO断键形成C和O
B.CO和O生成了具有极性共价键的CO2
C.CO和O生成CO2是吸热反应
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为Fe,则丁可能是Cl2
B.若甲为焦炭,则丁可能是O2
C.若甲为SO2,则丁可能是氨水
D.若甲为NaOH 溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
下列实验操作、现象与实验结论一致的是
选项
实验操作、现象
实验结论
A
向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失
该溶液中有SO42-
B
甲苯中滴入少量浓溴水,振荡,静置,溴水层褪色
甲苯与溴发生了取代反应
C
将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置
氧化性:Fe3+>Br2>I2
D
除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象
铁钉表面形成了一层致密稳定的氧化膜
难度: 中等查看答案及解析
-
紫罗兰酮是存在于玫瑰花、番茄等中一种天然香料,它多步反应可合成维生素A1,
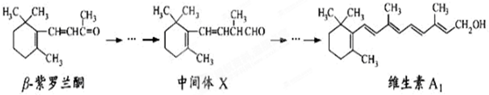
下列说法正确的是
A.
紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色
B.
紫罗兰酮分子式为:C13H22O
C.
mol中间体X最多能与
mol H2发生加成反应
D.
紫罗兰酮与中间体X互为同分异构体
难度: 中等查看答案及解析
-
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极。实验时,若断开K1,闭合K2,两极均有气泡产生, 下列有关描述正确的是
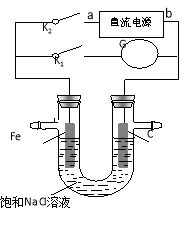
A.断开K1闭合K2时,总反应的离子方程式为:2H++2Cl-
H2↑+Cl2↑
B.断开K1闭合K2时,电子沿“a →Fe→电解质溶液→C→b”的路径流动
C.断开K1闭合K2时,铁电极附近溶液pH逐渐升高
D.断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
难度: 中等查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+ 3B2(g)
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
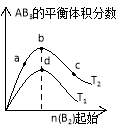
A.若
>
,则正反应是放热反应
B.达到平衡时
的转化率大小为:b>a>c
C.若
>
,达到平衡时b、d点的反应速率为
>
D.在
和
不变时达到平衡,
的物质的量大小为:c>b>a
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=―lg[OH―])与pH的变化关系如图所示,则
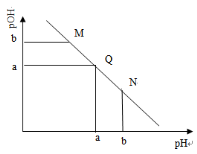
A.M点所示溶液的导电能力强于Q点
B.M点和N点所示溶液中H2O的电离程度相同
C.N点所示溶液中c(CH3COO―)>c(Na+)
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列判断合理的是
A.元素W分别与X、Y、Z形成的化合物都是离子化合物
B.四种元素简单离子的半径:X < Y < Z < W
C.Z与其他三种元素形成的常见化合物中有离子晶体、原子晶体和分子晶体
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如下图所示。下列说法不正确的是
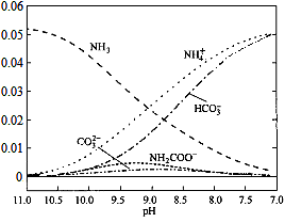
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
难度: 困难查看答案及解析
-
某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液,在溶液中逐滴滴加稀盐酸。下列离子方程式与事实不相符的是
A.HCO3-+CO32-+3H+ →2CO2↑+2H2O
B.HCO3-+3CO32-+7H+ →4CO2↑+4H2O
C.2HCO3-+CO32-+4H+ →3CO2↑+3H2O
D.CO32-+H+ →HCO3-
难度: 中等查看答案及解析
-
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S + 3O2 →2Cu2O + 2SO2……① 2Cu2O + Cu2S →6Cu + SO2……②。则下列说法正确的是
A.反应②中Cu2S只发生了氧化反应
B.反应①中氧化产物只有SO2
C.若1molCu2S完全转化为2molCu,则转移电子数为2NA
D.将1molCu2S冶炼成2molCu,需要O2 1mol
难度: 中等查看答案及解析
-
在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则下列正确的是
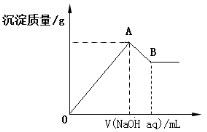
A.x=
B.x的取值范围是0<x<11/32
C.A点横坐标的值不随x发生变化
D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
难度: 中等查看答案及解析



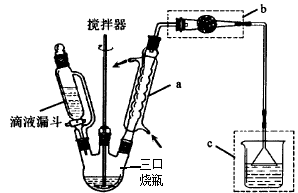
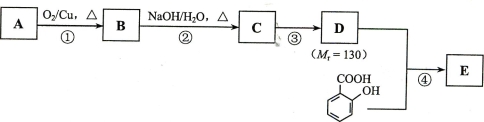
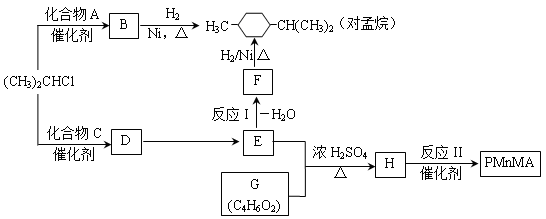
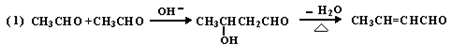 ,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下: