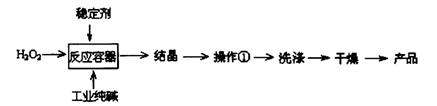
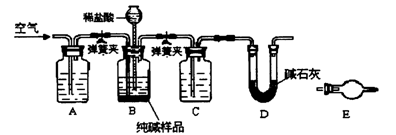
-
关于血糖浓度的调节,有关说法不正确的是 ①血糖平衡的调节既有神经调节又有激素调节,②调节血糖平衡的激素只有胰岛素和胰高血糖素,③下丘脑的不同区域参与血糖调节,④胰岛细胞只感受血糖浓度的变化而分泌相应的激素。
A.①④ B.②④ C.②③ D.①③
难度: 中等查看答案及解析
-
右图为碳循环的主要途径,下列有关叙述错误的是

A.图中B能实现光能—电能—化学能的转化
B.由B→C→D能量传递效率是变化的
C.B、C、D被E食用而处于第二、三、四营养级
D.B、E是实现生物群落与无机环境沟通的关键环节
难度: 中等查看答案及解析
-
下列说法不正确的是
A.硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物
B.油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂
C.处理废水时可加入明矾作为混凝剂,以吸附水中的杂质
D.玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要石灰石
难度: 中等查看答案及解析
-
下列说法中不正确的是(NA代表阿伏加德罗常数的值)
A.13C与14C属于同一种元素,它们互为同位素
B.28g乙烯和氮气的混合气体中含有NA个气体分子
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.常温下,1mol·L-1的 Na2CO3溶液中阴离子总数大于2NA
难度: 中等查看答案及解析
-
已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是
A.C元素的最高正价为+7价 B.离子半径:A2->C->B2+
C.对应气态氢化物的稳定性A>C D.还原性:A2-<C-
难度: 中等查看答案及解析
-
下列关于有机物的叙述正确的是
A.棉花、羊毛、粘胶纤维均属于天然纤维
B.乙烯和苯均能与酸性高锰酸钾溶液反应
C.淀粉和纤维素都能在一定条件下发生水解反应生成葡萄糖
D.将铜片在酒精灯上加热变黑后迅速插入乙醇溶液中,铜片恢复红色且质量减小
难度: 中等查看答案及解析
-
下列叙述正确的是
A.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳
B.将氢氧化铁胶体与氯化铁溶液分别加热蒸干并灼烧,最终得到的物质成分不同
C.向NaClO溶液中通入足量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO
D.铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2∶3
难度: 中等查看答案及解析
-
室温下,0.1mol·L-1某一元弱碱(AOH)溶液中c(OH-)/c(H+)=1.0×108,下列叙述不正确的是
A.该一元碱溶液的pH=11
B.该溶液中由水电离出的c(OH-)=1.0×10-11mol·L-1
C.该溶液中水的离子积常数KW为1.0×10-14mol·L-2
D.用pH=1的盐酸溶液V1L与V2L0.1mol·L-1的AOH溶液混合,若混合溶液pH=7,则V1=V2
难度: 中等查看答案及解析
-
常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液,滴定曲线如右图。下列说法正确的是
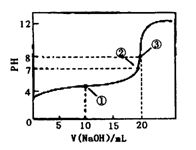
A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH] +[H+]
B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-]
C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+]
D.滴定过程中可能出现:[CH3COOH]>[CH3COO-]>
[H+]>[Na+」>[OH-]
难度: 中等查看答案及解析