-
已知:在25时H2O H++OH- KW=10-14
H++OH- KW=10-14
HAC H++A
H++A Ka=1.8×10-5
Ka=1.8×10-5
(1)醋酸钠水解的平衡常数Kh的表达式为。当升高温度时,Kh将________(填“增大”“减小”“不变”);
(2)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为________,a与b的关系为________(填“大于”“小于”“等于”);
(3)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为 0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中能生成沉淀,原因是________。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、
 =2.2)
=2.2)
-
已知:在室温下有以下平衡:
| 编号 | 平衡方程式 | 平衡常数 |
| ① | HCN⇌H++CN- | Ka=1×10-10 |
| ② | H2O⇌H++OH- | Kw=1×10-14 |
| ③ | CN-+H2O⇌HCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01mol•L-1HCN,可用甲基橙做指示剂
C.0.2mol•L-1的HCN溶液中加入等体积的0.1mol•L-1NaOH溶液,则该溶液呈碱性
D.0.2mol•L-1的HCN溶液中加入等体积的0.1mol•L-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
-
水的电离过程为:H2O H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14,则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14,则下列叙述正确的是
A. c(H+)随着温度的升高而降低 B. 在35℃时,c(H+)>c(OH-)
C. 蒸馏水中通HCl,Kw增大 D. 水的电离是吸热过程
-
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是
A. c(H+)随着温度升高而降低 B. 在35℃时,c(H+)>c(OH-)
C. 蒸馏水中通HCl,Kw增大 D. 水的电离是吸热的
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
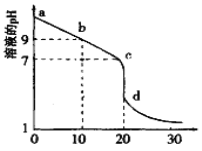
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
-
已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是__________。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1 HF溶液的pH约等于__________(已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_______(填“酸”、“碱”或“中”)性,并结合有关数据解释原因:_____________。
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。回答下列问题:
①试推断NH4HCO3溶液的pH__________7(填“>”、“<”或“=”);
②将四种溶液按NH4+浓度由大到小的顺序排列是:__________(填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________。
(4)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
-
下图表示常温下稀释醋酸和次氯酸两种酸的稀溶液时,溶液pH随加水量的变化而变化的曲线。(已知:25℃时,CH3COOH的电离平衡常数Ka=1.8×10-5;HClO的电离平衡常数Ka=3.0×10-8。)下列说法正确的是 ( )

A.曲线M代表HClO溶液加水稀释情况
B.a点酸溶液中水电离的c(H+)小于b点酸溶液中水电离的c(H+)
C.b、c两点处的溶液中c(R-)/[c(HR)·c(OH-)]相等(HR代表CH3COOH或HClO)
D.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
-
(14分)已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka= ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh= (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是_______________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。如在25 ℃时碳酸的K1 草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显 性,而草酸氢钠溶液显酸性。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=_________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用____________(填一种实验方法)测定溶液浓度c′。
-
现有 0.175 mol·L-1醋酸钠溶液500 mL,(已知室温下,醋酸的电离平衡常数Ka=1.75×10-5)。
⑴ 写出醋酸钠水解反应的化学方程式______________________________;
⑵ (双选) 下列图象能说明醋酸钠的水解反应达到平衡的是____________;
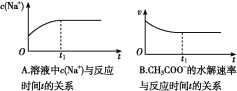
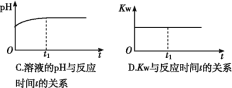
⑶ (双选) 向醋酸钠溶液中加入少量下列物质,水解平衡向正向移动的有______;
A.冰醋酸 B.纯碱固体 C.醋酸钠固体 D.氯化铵固体
⑷ (双选) 在醋酸钠溶液中加入冰醋酸,溶液中微粒浓度的关系式能成立的有__________;
A.c(CH3COO-) + c(CH3COOH) > c(Na+)
B.c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COO-) > c(H+) > c(OH-) > c(Na+)
⑸ 欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取___________g无水醋酸钠,溶于适量水中,配成500 mL溶液。[已知:M(CH3COONa) = 82g/mol ]
方案二:用体积均为250 mL且浓度均为___________mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
⑹ 在室温下,0.175 mol·L-1醋酸钠(CH3COONa)溶液的pH约为__________。
-
已知:25 C 时,Ksp[Zn(OH)2]= 1.0×10-18, Ka(HCOOH)= 1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解平衡常数为 1.0×10-10
B. 向 Zn(OH)2 悬浊液中加少量 HCOOH,溶液中 c(Zn2+)增大
C. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6 mol/L
D. Zn(OH)2(s) +2HCOOH(aq) Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
H++OH- KW=10-14
H++A
Ka=1.8×10-5
=2.2)


