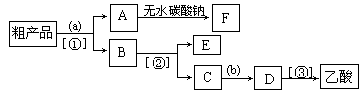
-
下列化学用语正确的是( )
A. 甲烷分子的比例模型:
B. 二氧化碳的电子式:
C. Cl-的结构示意图为:
 D. HClO的结构式:H-O-C1
D. HClO的结构式:H-O-C1难度: 简单查看答案及解析
-
下列说法正确的是( )
A. CH4能使酸性KMnO4溶液褪色
B. 金属Na能与C2H5OH中的甲基反应生成H2
C. 乙酸有强烈的刺激性气味,其水溶液称为冰醋酸
D. CH3CH2CH2CH3与CH3CH(CH3)互为同分异构体
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是
A.
 B.
B. 
C.
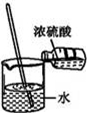 D.
D. 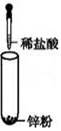
难度: 简单查看答案及解析
-
对于下列事实的解释正确的是( )
A. 氢氟酸可用于雕刻玻璃,说明氢氟酸具有强酸性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸具有强氧化性
C. 常温下浓硫酸可用铝罐贮存,说明铝与浓硫酸不反应
D. 氨水中可使酚酞试剂变为红色,说明氨水显碱性
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A. 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火
B. 用石英制成光导纤维,由水玻璃制硅胶都是化学变化
C. 火法炼铜、湿法炼铜都是置换反应
D. 糖类、油脂、蛋白质都是高分子化合物
难度: 简单查看答案及解析
-
下列叙述中不正确的是( )
A. 糖类和蛋白质都是人体重要的营养物质
B. 鸡蛋白可以水解得到氨基酸
C. 液化石油气和天然气的主要成分都是甲烷
D. 利用油脂在碱性条件下的水解,可以制得肥皂和甘油
难度: 简单查看答案及解析
-
己知25 C、101 kPa下,下列反应C(石墨)+O2(g)=CO2(g),△H=-393.51kJ/mol;C(金刚石)+O2(g)=CO2(g),△H=-395.41kJ/mol 可以得出的结论是( )
A. 金刚石比石墨稳定 B. 1mol石墨所具有的能量比1mol金刚石低
C. 金刚石转变成石墨是物理变化 D. 石墨和金刚石都是碳的同位素
难度: 简单查看答案及解析
-
四种短周期元素在周期表中的位罝如图,其中只有M为金属元素。下列说法不正确的是( )
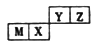
A. 原子半径Z
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第VIA族
难度: 中等查看答案及解析
-
镭是元素周期表中第7周期IIA族元素,下列关于镭的性质的叙述中不正确的是( )
A. 在化合物中呈+2价 B. 单质能与水反应放出H2
C. 它的氢氧化物为强碱 D. 镭元素的金属性比钡元素的弱
难度: 简单查看答案及解析
-
下列反应的离子方程式,正确的是( )
A. Fe溶于稀盐酸:2Fe+6H+ = 2Fe3++3H2↑
B. 用小苏打治疗胃酸过多:CO32-+2H+=CO2+H2O
C. 用FeCl3溶液腐蚀印刷电路板上铜:Fe3++Cu=Fe2++Cu2+
D. 铝与浓氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2
难度: 简单查看答案及解析
-
下列实验装罝或操作不符合实验要求的是( )
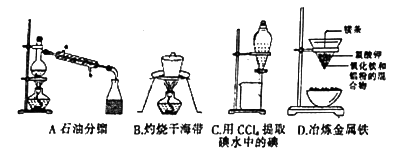
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列物质性质的递变关系正确的是( )
A. 酸性强弱:HC1O3>H2SO3>H3PO4 B. 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2
C. 稳定性HCl>H2S>PH3 D. 氧化性Na+>Mg2+>Al3+
难度: 简单查看答案及解析
-
下列说法正确的是( )
①二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
②根据反应SiO2+CaCO3
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
③二氧化碳通入硅酸钠溶液中可以制得硅酸
④二氧化硅常被用来制造光导纤维
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )
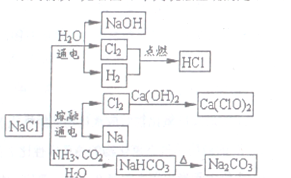
A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
难度: 简单查看答案及解析
-
化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
A. 绿色化学的核心是应用化学原理对环境污染进行治理
B. 蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C. PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D. 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物
难度: 简单查看答案及解析
-
下列除杂试剂的选择或除杂操作不正确的是( )
选项
括号内为杂质
除杂试剂
除杂操作
A
Fe (A1)粉
NaOH溶液.
在过量的NaOH溶液中充分反应后过滤
B
Na2O2(Na2O)固体
O2
在纯氧气中加热
C
FeCl2(FeCl3)溶液
Fe粉
加入过量Fe粉,充分反应后过滤
D
Na2CO3(NaHCO3)溶液
CO2
通入过量的CO2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
根据如图的转化关系判断下列说法正确的是(反应条件己略去) ( )
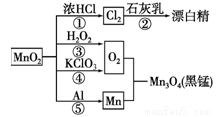
A. 只有反应①②④均属于氧化还原反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
在一定温度下的恒容容器中.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)
2C(g)+D(g)己达平衡状态的是( )
A. 混合气体的压强 B. 混合气体的密度
C. 3v逆(C)=2v正(B) D. 气体的平均相对分子质量
难度: 中等查看答案及解析
-
下列变化的实质相似的是( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小②二氧化硫和氯气均能使品红溶液褪色③二氧化硫能使品红溶液、溴水褪色④氨气和碘化氢气体均不能用浓硫酸干燥⑤常温下浓硫酸用铁制容器存放、加热条件下浓硫酸能与木炭反应⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字⑦二氧化碳、二氧化硫使澄清石灰水变浑浊
A. 只有②③④ B. 只有⑤⑦
C. 只有③④⑥⑦ D. 全部
难度: 简单查看答案及解析
-
在一定温度下,把3.0molM和2.5mol N混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g)
XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
A. X的值为1 B. M的平均反应速率为0.15 mol•L-1·min-1
C. M的转化率为60% D. 平衡时P的浓度为0.25 mol•L-1
难度: 简单查看答案及解析
-
将1.92gCu投入盛有一定量浓硝酸的试管中,当在标准状况下收集到1.12L气体时,金属铜恰好全部消耗。则反应中消耗的硝酸的物质的量为
A. 0.09mol B. 0.1.mol C. 0.11mol D. 0.12 mol
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键和共价键的断裂和形成的反应是( )
A. NH4Cl
NH3↑+HC1↑ B. NH3+CO2+H2O=NH4HCO3
C. 2NaBr+Cl2=2NaCl+Br2 D. CuSO4+Fe=Cu+FeSO4
难度: 简单查看答案及解析
-
在C(s)+CO2(g) = 2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2。其中能够使反应速率增大的措施是( )
A. ①④ B. ②③⑤ C. ①③ D. ①②④
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=Ag+Zn(OH)2。下列说法中错误的是( )
A. 原电池放电时,负极上发生反应的物质是Zn
B. 溶液中OH-向正极移动,K+、 H+向负极移动
C. 工作时,负极区溶液pH减小,正极区pH增大
D. 负极上发生的反应是Zn+2OH--2e-=Zn(OH)2
难度: 简单查看答案及解析
-
某同学设计如下元素周期表,己知X元素的气态氢化物水溶液呈碱性,空格中均有对应的元素填充。以下说法正确的是
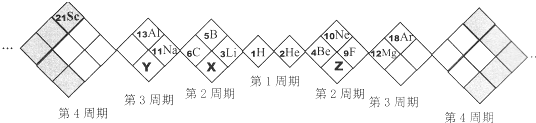
A. X、Y、Z元素分别为N、P、O
B. 白格中都是主族元素,灰格中都是副族元素
C. 原子半径:Z>X>Y
D. X、Y、Z的气态氢化物中最稳定的是:X的氢化物
难度: 中等查看答案及解析