-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变难度: 中等查看答案及解析
-
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面.下列说法不正确的是( )
A.锡青铜的熔点比纯铜低
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成的Cu2(OH)3Cl俗名为铜绿难度: 中等查看答案及解析
-
下列关于强、弱电解质的叙述中,错误的是( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯的强电解质在液态时,有的导电,有的不导电难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液
B.c(H+)=10-7mol•L-1的溶液
C.c(H+)/c(OH-)=10-14溶液
D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-)难度: 中等查看答案及解析
-
对汽车尾气的处理有人提出下列做法:在马路上铺设“光触媒”(如二氧化钛)物质,将空气中的氮氧化物、一氧化碳、二氧化硫等污染物在催化剂表面转化、分解成对人体、环境基本无害的物质.下列有关说法正确的是( )
A.此法可将汽车尾气中的CO在催化剂表面氧化生成CO2
B.此法可将汽车尾气中的NOx在催化剂表面氧化生成N2
C.此法可将汽车尾气中的二氧化硫还原成三氧化硫
D.此法是解决城市空气污染的唯一途径难度: 中等查看答案及解析
-
下列叙述,从化学角度分析正确的是( )
A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
B.绿色食品是指使用过化肥和农药生产出来的农副产品
C.加碘食盐中加入的I2有利于防止地方缺碘病
D.在煤炭中加入生石灰可以减少SO2的排放,减少酸雨的发生难度: 中等查看答案及解析
-
根据实验目的判断下列实验操作或装置正确的是( )
A.
制备氢氧化亚铁并观察其颜色
B.
石油的分馏实验
C.
制备并检验氢气的可燃性
D.
浓硫酸稀释难度: 中等查看答案及解析
-
下列叙述中不正确的是( )
A.俄国化学家门捷列夫发现了元素周期律
B.意大利科学家阿佛加德罗提出了分子的概念
C.P和As属于第VA族元素,H3PO4酸性比H3AsO4的强
D.原子序数为8和14的元素能形成原子数之比为1:1的稳定化合物难度: 中等查看答案及解析
-
下列各组物质相互混合,既有气体生成最终又有沉淀生成的是( )
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液 ③浓硫酸铵溶液加入到氯化钡溶液中④Na2O2投入FeCl2溶液中.
A.①④
B.②③
C.①③
D.③④难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将CO2通入饱和Na2CO3溶液中有沉淀产生,继续通人CO2,沉淀溶解
B.向BaCl2溶液中加入Na2SO3产生沉淀,再通入NO2,沉淀完全溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加过量NaHSO4溶液,沉淀消失
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解难度: 中等查看答案及解析
-
某混合溶液中只含有两种溶质NaCl和CuSO4,且n(NaCl):n(CuSO4)=3:2.若以石墨电极电解该溶液,下列推断中不正确的是( )
A.整个电解过程,最后电解的是水
B.阳极先析出Cl2,后析出O2
C.整个电解过程分三个阶段,第二阶段电解的是硫酸铜和水
D.阴极自始至终只析出铜难度: 中等查看答案及解析
-
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的△H>0难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
①氯气与水反应Cl2+H2O=2H++Cl -+ClO-
②将金属钠加入水中 2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于醋酸CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
⑤小苏打溶液中加入少量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
⑥Na2S溶液呈碱性:S2-+H2O=HS-+OH-
⑦钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu
⑧硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
A.①②⑤
B.②③⑤
C.④⑥⑦
D.②③⑧难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
①36g D2O含有的电子数为20NA;
②15.6g Na2O2 与过量CO2反应时,转移的电子数为0.2NA;
③含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA;
④在标准状况下,22.4LCH2Cl2的物质的量为1mol;
⑤标况下,2.24LSO3中含有0.1NA个SO3分子;
⑥6.4gCu与过量硫粉反应,转移电子数为0.1NA.
A.②⑥
B.③⑤
C.②④
D.②⑤难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在25℃下,将a mol•L-1的醋酸(HAc)与0.01mol•L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na*)=c(Ac-).则下列说法中,不正确的是( )
A.此时醋酸和氢氧化钠溶液恰好中和
B.反应平衡时溶液显中性
C.用含a的代数式表示醋酸(HAc)的电离常数为Ka=mol•L-1
D.a肯定大于0.01难度: 中等查看答案及解析
-
下列有关溶液中相关量的关系描述不正确的是( )
A.pH=2的盐酸和pH=2的醋酸溶液混合后:pH=2
B.100mL1.0 mol•L-1Fe(NO3)2溶液和100mL2.0 mol•L-1 HNO3溶液混合后:c(NO3-)=2.0 mol•L-1
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(NaClO)
D.0.1 mol•L-1的KHA溶液,其pH=10:c(HA-)>c(OH-)>c(H+)>c(A2-)难度: 中等查看答案及解析
-
已知酸性条件下有反应:2Cu+═Cu2++Cu.氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体.某同学对某次氢气还原氧化铜的红色固体产物作了如下实验,实验操作和实验现象列表如下:
由此推出本次氢气还原氧化铜实验的产物( )加入试剂 稀硫酸 浓硫酸并加热 稀硝酸 浓硝酸 实验现象 红色固体
不反应无色气体 无色气体
蓝色溶液红棕色气
体蓝色溶液
A.是Cu
B.一定有Cu,一定有Cu2O
C.是Cu2O
D.一定有Cu2O,可能有Cu难度: 中等查看答案及解析
-
用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图示步骤分开五种离子,则溶液①④是( )
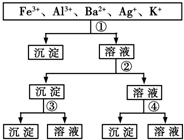
A.①NH3•H2O ④NaCl
B.①NaCl ④H2SO4
C.①NaOH ④H2SO4
D.①H2SO4④NaCl难度: 中等查看答案及解析
-
关于下列四个图象的说法中正确的是( )
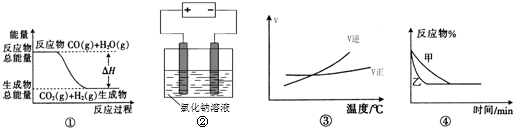
A.图①表示可逆反应“CO(g)+H2O(g)⇌CO2(g)+H2(g)”中的△H大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g)⇌2AB3(g)”的△H小于0
D.图④表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大难度: 中等查看答案及解析