-
下列化学用语正确的是
A. CO2的结构式O=C=O B. HCl的电子式

C. 氯离子结构示意图
 D. 作为相对原子质量标准的原子
D. 作为相对原子质量标准的原子难度: 简单查看答案及解析
-
下列反应的热效应与其它三项不相同的是
A. 铝粉与氧化铁的反应 B. 钠与冷水反应
C. 锌片与稀硫酸反应 D. 氯化铵与Ba(OH)2·8H2O反应
难度: 简单查看答案及解析
-
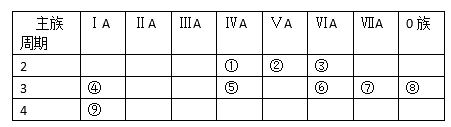
下列叙述中正确的是
A. 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数
B. ⅦA族元素其简单阴离子的核外电子层数等于该元索所在的周期数
C. 除短周期外,其他周期均有18种元素
D. X2+的核外电子致目为18,则X在第三周期第ⅡA族
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是
A. v(H2)=0.1mol/(L·s) B. v(N2)=0.2mol/(L·min)
C. v(NH3)=0.15mol/(L·min) D. v(H2)=0.3mol/(L·min)
难度: 简单查看答案及解析
-
己知反应A+B=C+D的能量变化如图所示,下列说法不正确的是
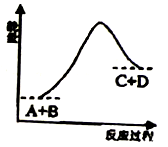
A. 只有在加热条件下该反应才能进行
B. 该反应是吸热反应
C. 反应物的总能量低于生成物的总能量
D. 反应中断开化学键吸收的总能量高于形成化学键放出的总能量
难度: 简单查看答案及解析
-
下列事实不能说明X元素比Y元素的非金属性强的是
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. 在氧化还原反应中,甲失的电子比乙多
D. X单质可以把Y从其氢化物中置换出来
难度: 中等查看答案及解析
-
铅蓄电池是机动车上常用的化学电源,其两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列结论正确的是
A. Pb为正极被氧化 B. PbO2为负极被氧化
C. 电解质溶液浓度不断减小 D. 溶液的pH不断减小
难度: 中等查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A. 1H与D互称同位素 B. 1H218D通过化学变化不能实现
C. H2O与D2O的摩尔质量相同 D. 1H218O与D216O的物理性质不同
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是
A. 四种元素位于同一周期 B. 氢化物的稳定性:H2Y>H2
C. 原子序数a>b>d>c D. a+3=c-2
难度: 中等查看答案及解析
-
已知COCl2(g)
CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④扩大容积 ⑤加催化剂 ⑥恒压通入情性气体,能提高COCl2转化率的是
A. ①②④ B. ①④⑥ C. ②③⑥ D. ③⑤⑥
难度: 中等查看答案及解析
-
己知N≡N键能为945.6kJ·mol-1,N-H键能为39l kJ·mol-1,根据热化学方程式:N 2 (g ) +3H2(g)
2NH3(g) ,△H=-92.4kJ·mol-1,则H-H键的键能是
A. 45 kJ·mol-1 B. 436 kJ·mol-1 C. 1308 kJ·mol-1 D. 135 kJ·mol-1
难度: 中等查看答案及解析
-
下列有关元素性质的递变规律不正确的是
A. Na、Mg、Al的金属性依次减弱 B. H2S、H2O、HF的稳定性依次减弱
C. Cl-、Br-、I-还原性依次增强 D. Na、K、Rb的原子半径依次增大
难度: 中等查看答案及解析
-
碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,电解质是KOH,下列说法正确的是
A. MnO2发生了氧化反应
B. MnOOH中Mn元素的化合价为+3
C. 反应消耗0.65gZn,有0.01mol电子发生转移
D. 电池正极的反应为:Zn+2OH--2e-=Zn(OH)2
难度: 中等查看答案及解析
-
在一定温度时,N2与H2反应过程中能量变化的曲线如图,下列叙述正确的是
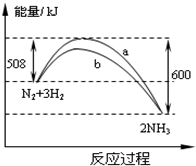
A. 该反应的热化学方程式为:N2+3H2
2NH3 △H=-92kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的放热减少
D. 反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
反应4A(g)+5B(g)=4C(g)+6D(g) △H=-QkJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是
A. 若增大压强,A和B的转化率都增大
B. 若升高温度最终能生成更多的C和D
C. 单位时间里有4nmolA消耗,同时有5nmolB生成
D. 容器里A、B、C、D的浓度比是4:5:4:6
难度: 简单查看答案及解析
-
我国拥有完全自主产权的氢氧燃料电池已得到大量应用。某种氢氧燃料电池的电解液为KOH溶液, 有关该电池的叙述不正确的是
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 该电池每消耗2.24LO2(标准状况)时,有0.2mol电子转移
难度: 中等查看答案及解析
-
反应CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正反应速率增大、逆反应速率减小
C. 增大CO(NH2)2的量, CO2的转化率减小
D. 降低温度,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
甲、乙、丙、丁都是短周期元素,其中甲、丁在周期表中的相对位置如下表,甲原子最外层电子数是其内层电子数的2倍,乙单质在空气中燃烧发出黄色火焰,丙是地壳中含量最高的金属元素。下列判断正确的是
甲
丁
A. 原子半径:丙>丁 B. 甲与丁的核外电子数相差10
C. 氢氧化物碱性:丙>乙 D. 甲、乙的最高价氧化物均是共价化合物
难度: 中等查看答案及解析
-
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池负极的电极反应为:4H++O2+4e-=2H2O
D. 电池工作时,1mol乙醇被氧化时就有12mol电子转移
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
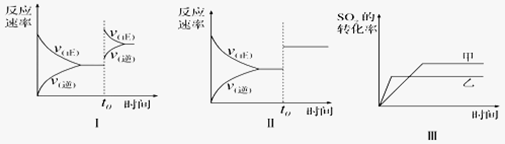
A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻增大压强后对反应速率的影响
C. 图III研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影晌.且乙的温度较高
难度: 中等查看答案及解析