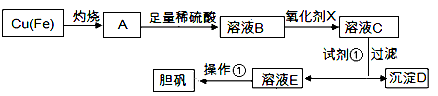
-
在H2O中加入等物质的量的Ag+、Na+、Ba2+、NO3-、SO42-、Cl-,该溶液在惰性电极的电解槽中通电片刻后,氧化产物和还原产物的质量比是
A.1:8 B.8:1 C.35.5:108 D.108:35.5
难度: 困难查看答案及解析
-
下列实验装置能达到实验目的的是
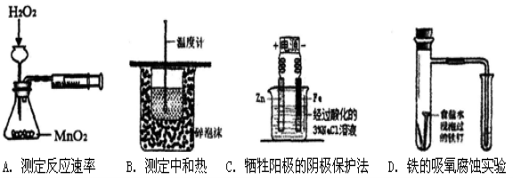
难度: 中等查看答案及解析
-
250 mL K2SO4和CuSO4的混合溶液中c(SO42-)=0.5 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下)。假定电解后溶液体积仍为250 mL,下列说法不正确的是
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 mol·L-1
D.原混合溶液中c(K+)=0.6 mol·L-1
难度: 困难查看答案及解析
-
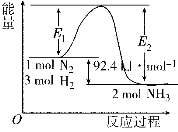
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
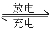 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
难度: 困难查看答案及解析
-
有关能量的判断或表示方法正确的是
A.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g) = 2 H2O(l) △H=-285.8kJ/mol
D.从C(石墨)=C(金刚石) △H=+1.9kJ/mol,可知石墨比金刚石更稳定
难度: 中等查看答案及解析
-
高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,电能转化为化学能而“储存”在反应物中;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②③④ B.①③④⑤ C.②③⑤ D.①②④⑤
难度: 中等查看答案及解析
-
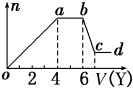
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
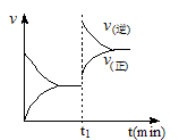
A.2SO2(g)+O2(g)
2SO3(g) △H<0
B.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H<0
C.H2(g)+I2(g)
2HI(g) △H>0
D.C(s)+H2O(g)
CO(g)+H2(g) △H>0
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H= -24.8 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H= -47.2 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO (s)+CO2(g) △H= +640.5 kJ·mol-1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为
A.放出218 kJ B.放出109kJ C.吸收218 kJ D.吸收109 kJ1
难度: 困难查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是)

难度: 困难查看答案及解析
-
在恒容绝热条件下,一定能说明反应A(g)+B(?)
2C(g)已达到平衡状态的是
A.容器内的密度不再变化
B.C的生成速率与A的分解速率之比为2:1
C.混合物的平均摩尔质量不再变化
D.容器内的温度不再发生变化
难度: 中等查看答案及解析
-
某反应2AB(g)
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的正反应的△H、△S应为
A.△H<0, △S>0 B.ΔH<0,△S<0
C.△H>0,△S>0 D.△H>0,△S<0
难度: 中等查看答案及解析
-
反应mA(s)+nB(g)
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如右图所示,下列叙述中一定正确的是
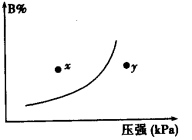
①m+n>p
②x点表示的正反应速率大于逆反应速率
③n>p
④x点逆反应速率比y点时的正反应速率慢
⑤若升高温度,该反应的平衡常数增大
A.①②⑤ B.只有②④
C.只有①③ D.①③⑤
难度: 困难查看答案及解析
-
在恒温、恒容下,发生如下反应:2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是
A、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率
B、达到平衡时,途径I所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C、两途径最终达到平衡时,体系内各组分的百分含量相同
D、两途径最终达到平衡时,体系内各组分的百分含量不相同
难度: 困难查看答案及解析
-
下列实验现象与结论不一致的是
实验操作(或设计)
实验现象
结论
A
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体
HA放出的氢气多且反应速率快
酸性:HB > HA
B
以镁、铝、氢氧化钠溶液构成原电池
镁表面有气泡
镁作原电池的负极
C
相同温度下,等质量的大理石与等体积等浓度的盐酸反应
粉状大理石产生气泡更快
反应速率:
粉状大理石>块状大理石
D
向盛有10滴0.1 mol·L-1 AgNO3溶液的试管中滴加0.1 mol·L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol·L-1 NaI溶液
先有白色沉淀,后转成黄色沉淀
Ksp(AgCl )> Ksp (AgI)
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.100 mL 2.0 mol·L-1 NH4Cl溶液中含有NH4+ 的数目为0.2NA
B.25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
C.标准状况下,2.24L庚烷含有的分子数为0.1NA
D.常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA
难度: 困难查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-)
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
D.pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
难度: 困难查看答案及解析
-
25℃时,弱酸的电离平衡常数如表,下列说法正确的是
弱酸
CH3COOH
HCN
H2CO3
K
1.8×10-5
4.9×10-10
K1=4.3×10-7 K2=5.6×10-11
A.等物质的量浓度溶液pH关系: pH(NaCN)> pH(Na2CO3)> pH(CH3COONa)
B.amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO32-)
难度: 困难查看答案及解析
-
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是

难度: 困难查看答案及解析
-
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述正确的是
A.M的单质能够用来制造光导纤维
B.Z、W、M的氧化物均可做耐高温材料
C.工业上常用电解熔融氯化物的方法制备Z、W的单质
D.Y的单质都有剧毒,而且其着火点低,常保存在冷水中
难度: 困难查看答案及解析
-
组成和结构可用
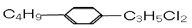 表示的有机物共有(不考虑立体异构体)
表示的有机物共有(不考虑立体异构体)A.9种 B.12种 C.24种 D.36种
难度: 困难查看答案及解析
-
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,右图是异辛烷的球棍模型,则异辛烷的系统命名为
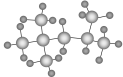
A.1,1,3,3-四甲基丁烷 B.2,2,4-三甲基丁烷
C.2,4,4-三甲基戊烷 D.2,2,4-三甲基戊烷
难度: 中等查看答案及解析