-
(10分)现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________。
A. c(H+) B. c(H+)/ c(CH3COOH)
C. c(H+)·c(OH-) D. c(OH-)/ c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)_____pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,两种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10-5
4.3×10-7
3.0×10-8
K2
——
5.6×10-11
——
下列四种离子结合H+能力最强的是______________。
A. HCO3- B. CO32- C. ClO- D. CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):_________________;
HClO+Na2CO3(少量):___________________。
高二化学填空题极难题查看答案及解析
-
现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是______.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡______(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH) 的比值将______(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)______ V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10﹣5
4.3×10﹣7
3.0×10﹣8
K2
﹣﹣
5.6×10﹣11
﹣﹣
下列四种离子结合H+能力最强的是______.
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(5)常温下,取甲溶液稀释100倍,其pH=______;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______.
高二化学填空题中等难度题查看答案及解析
-
现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是______.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡______(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH) 的比值将______(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)______ V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10﹣5
4.3×10﹣7
3.0×10﹣8
K2
﹣﹣
5.6×10﹣11
﹣﹣
下列四种离子结合H+能力最强的是______.
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(5)常温下,取甲溶液稀释100倍,其pH=______;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______.
高二化学填空题中等难度题查看答案及解析
-
现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是______.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡______(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH) 的比值将______(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)______ V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10﹣5
4.3×10﹣7
3.0×10﹣8
K2
﹣﹣
5.6×10﹣11
﹣﹣
下列四种离子结合H+能力最强的是______.
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(5)常温下,取甲溶液稀释100倍,其pH=______;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______.
高二化学填空题中等难度题查看答案及解析
-
现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________。
A.c(H+)
B.c(H+)/ c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/ c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)_________pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,两种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10-5
4.3×10-7
3.0×10-8
K2
——
5.6×10-11
——
下列四种离子结合H+能力最强的是______________。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):_________________;
HClO+Na2CO3(少量):___________________。
高二化学填空题困难题查看答案及解析
-
现有常温下c(H+)=0.01mol/L的盐酸甲和c(H+)=0.01mol/L的醋酸溶液乙,回答下列问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据变大的是___________。
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)__ _________pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,三种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10-5
4.3×10-7
3.0×10-8
K2
5.6×10-11
下列四种离子结合H+能力最强的是______________。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
请写出在次氯酸钠溶液中通入少量二氧化碳气体的离子方程式:________________。
高二化学填空题困难题查看答案及解析
-
I.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.
C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)________(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=4.7×10-11
3.0×10-8
下列四种离子结合H+能力最强的是________。
A.HCO B.CO
C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
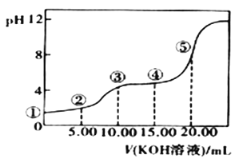
(5)点③所示溶液中所有离子的浓度由大到小的顺序为:________________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4−)+c(C2O42−)=________mol/L。
高二化学综合题困难题查看答案及解析
-
(每空2分,共6分)请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。
A.c(H+) B.
C.c(H+)·c(OH-) D.
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
高二化学填空题困难题查看答案及解析
-
现有甲、乙两种溶液:甲 pH=2(c(H+)=10-2 mol/L)的醋酸溶液
乙 pH=2(c(H+)=10-2 mol/L)的盐酸
请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或
“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),
待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其溶液中大小关系为:c(H+) (甲)________ c(H+) (乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)________ V(乙)(填“大于”、“小于”或“等于”)。
(4)下列事实能证明乙酸(CH3COOH)是弱电解质的是( )
A. 用乙酸(CH3COOH)溶液做导电性试验灯光较暗 B. 乙酸(CH3COOH)是共价化合物
C. 常温下,0.1 mol/L乙酸(CH3COOH)溶液的pH为2.2 D. 乙酸(CH3COOH)溶液不与NaCl反应
高二化学填空题简单题查看答案及解析
-
现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。试回答下列问题:
(1)甲溶液的pH=________。
(2)乙溶液中由水电离出的H+浓度为________mol·L-1。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③
④c(OH-)
(4)某同学用甲溶液做标准溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
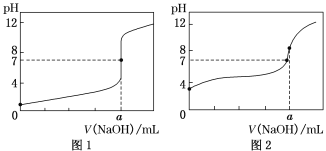
①甲溶液滴定丙溶液的曲线是_______(填“图1”或“图2”)曲线。
②用甲溶液滴定乙溶液实验中,指示剂应选用________,滴定达到终点的现象为:____________,滴定前未用标准液润洗滴定管,则会造成滴定结果______ (填偏高、偏低或无影响)。
高二化学综合题中等难度题查看答案及解析