-
一些装有化学物质的容器上常贴有危险化学品的标志。在装有
的试剂瓶上应贴的标志是

难度: 中等查看答案及解析
-
“纳米材料”是粒子直径为
的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③⑤ C.②③④ D.①③④⑥
难度: 简单查看答案及解析
-
下列各组离子反应可用H++OH-
H2O表示的是
A.氢氧化钡和硫酸 B.氢氧化铁和盐酸
C.次氯酸和氢氧化钠 D.硫酸氢钠和氢氧化钠
难度: 简单查看答案及解析
-
下列各组化合物中,化学键类型完全相同的是
A.C2H6、H2O2、C2H5OH
B.HCl、NaCl、MgCl2
C.H2O、CO2、Na2O2
D.NaOH、NaClO、Na2O
难度: 中等查看答案及解析
-
是常规核裂变产物之一,可以通过测定大气或水中
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
有叙述中错误的是
A.
的化学性质与
相同
B.
的原子序数为53
C.
的原子核外电子数为78
D.
的原子核内中子数多于质子数
难度: 中等查看答案及解析
-
下列有关表述正确的是
A.
与
组成元素相同,含有的电子数也相同
B.丙烷的分子的球棍模型为:

C.次氯酸的电子式为

D.熔化时
的电离方程式为
难度: 简单查看答案及解析
-
下列现象不是因为发生化学变化而产生的是
A.皮肤不慎沾上浓硝酸而呈黄色
B.久置的KI溶液呈黄色
C.盛在无色试剂瓶中的浓硝酸呈黄色
D.食盐撒在燃着液化气的火焰上,火焰呈黄色
难度: 简单查看答案及解析
-
表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 LSO3所含分子数约为0.5NA
B.1 mol Cl2参加反应转移的电子数一定为2NA
C.常温常压下,14g氮气和一氧化碳组成的混合气体所含原子数为NA
D.标准状况下,11.2L的CO2所含的共价键键数为NA
难度: 中等查看答案及解析
-
实验室中需要配制2mol/L的
溶液950mL,配制时应选用的容量瓶的规格和称取的
质量分别是
A.950mL,111.2g B.500mL,117g
C.1000mL,117g D.任意规格,111.2g
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A.
、
、
、
B.
、
、
、
C.
、
、
、
D.
、
、
、
难度: 中等查看答案及解析
-
下列实验操作中不正确的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
难度: 简单查看答案及解析
-
向25
2
/L Na2CO3 溶液中,逐滴加入1
/L 稀
75
,在标准状况下可产生CO2
A.840
B.84
C.560
D.56
难度: 中等查看答案及解析
-
下列说法正确的是
A.同主族元素的单质从上到下,熔点升高
B.元素的最高正化合价在数值上等于它所在的族序数
C.同周期主族元素的原子半径越小,越难失去电子
D.元素的非金属性越强,它的气态氢化物水溶液的酸性越强
难度: 简单查看答案及解析
-
下列离子方程式中不正确的是
A.FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O
C.硫代硫酸钠溶液中加入稀硫酸:2H++S2O32-=S↓+SO2↑+H2O
D.酸性高锰酸钾溶液中加入草酸:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
难度: 中等查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3=HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
A.5:3 B.5:4 C.1:1 D.3:5
难度: 中等查看答案及解析
-
下列说法正确的是
A.
与稀
、稀
反应均有气泡产生,说明
与两种酸均发生置换
B.
中阴阳离子数数目之比为1:1
C.
与
均能使品红褪色,说明二者均有氧化性
D.
能够与人体里的血红蛋白结合,造成人体缺氧中毒
难度: 简单查看答案及解析
-
下列反应能用化合直接制得的是
①
②
③
④
⑤
A.①②③⑤ B.②⑤
C.②③⑤ D.全部
难度: 简单查看答案及解析
-
通入
溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必要是可以加热)
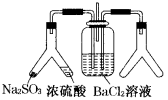
A.
和浓硝酸
B.
和浓氨水
C.大理石和稀盐酸
D.高锰酸钾溶液和浓盐酸
难度: 中等查看答案及解析
-
将足量的
不断通入
、
、
的混合溶液中,生成沉淀与通入
的量的关系可表示为

难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有
的盐酸和
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
难度: 中等查看答案及解析
-
(6分)将由
、
、
三种固体组成的 混合物溶于足量水,充分反应后得到
白色沉淀,向所得的浊液中逐滴加入
的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
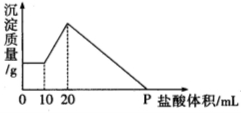
求:(1)分别求混合物中
、
物质的量
(2)
点时加入
的体积(要求写出计算过程)
难度: 中等查看答案及解析