-
下列叙述正确的是( )
A. NaOH可用于治疗胃酸过多 B. CaO可防止月饼等食品氧化变质
C. 氢弹中用到的2H、3H互为同位素 D. 石油分馏属于化学变化
难度: 简单查看答案及解析
-
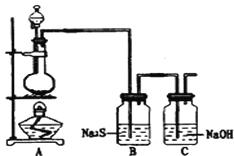
下列有关实验操作的叙述中正确的是

A. ①利用甘油密度大于乙醇且更易溶于水,进行甘油与乙醇的混合物分离
B. ②进行H2,NH3,CO2,Cl2,HCl,NO2等气体收集,也能用于NO气体收集
C. ③当X选用苯时可进行NH3和HCl的吸收,并防止倒吸
D. ④常用于实验室收集氧气、氢气等
难度: 中等查看答案及解析
-
下列说法正确的是
A.乙醇既可以发生催化氧化反应,又可以发生酯化反应
B.用溴水可以鉴别乙醇、乙酸和苯
C.糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素
D.C5H10O属于醛类的同分异构体为六种
难度: 简单查看答案及解析
-
X、Y、Z、R、W是短周期主族元素,X原子的最外层电子数是其次外层的2倍,Y是地壳中含量最高的元素,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和,W与Y属于同一主族。下列叙述正确的是
A. Y、Z、R元素简单离子的半径依次增大
B. 含有Y、Z、R三种元素的化合物最多只有2种
C. 元素W和R最高价氧化物对应水化物的酸性后者强
D. Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同
难度: 中等查看答案及解析
-
下列用于解释事实的离子方程式书写正确的是
A.铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+
B.硫化钠溶液呈碱性:S2-+2H2O
H2S+2OH-
C.氯水具有漂白性:Cl2+H2O
2H++Cl-+ClO-
D.工业上利用电解饱和食盐水制氯气:2H++2Cl-
H2↑+Cl2↑
难度: 中等查看答案及解析
-
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
A. 阳极反应为Fe-2e-=Fe2+
B. 电解过程中溶液pH不会变化
C. 过程中有Fe(OH)3沉淀生成
D. 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
难度: 困难查看答案及解析
-
常温下,向20mL 0.5mol·L-1的CH3COOH溶液中逐滴滴加0.5mol·L-1的NaOH溶液,滴定曲线如图。相关分析正确的是

A. 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应
B. 滴加至②时,c(OH-)—c(H+) =c(CH3COOH)
C. 滴定中,c(CH3COO-)/c(H+)逐渐减小
D. 滴定中,c(CH3COOH)与c(CH3COO-)之和保持不变
难度: 中等查看答案及解析
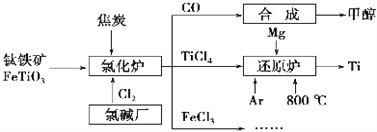
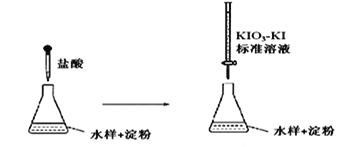
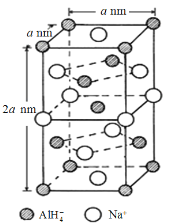
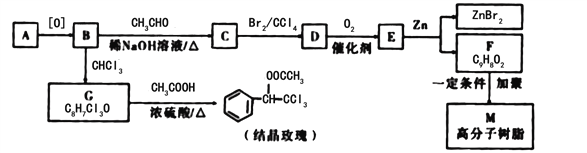
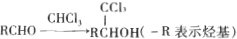
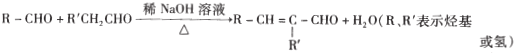
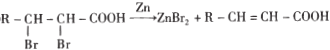
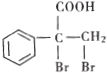 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以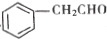 为原料设计它的合成路线(其他所需原料自选)_______________.
为原料设计它的合成路线(其他所需原料自选)_______________.