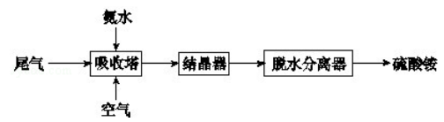
-
2016年1月1日起修订厉的《中华人民共和国大气污染防治法》正式施行,这将对我国的大气污染防治产生重要影响。下列有关说法正确的是( )
A.绿色食品就是不含任何化学物质的食品
B.燃煤时添加生石灰以减少SO2的排放
C.PM2.5是指环境空气中直径大于或等于2.5微米的颗粒物
D.pH在5.6~7.0之间的降水通常称为酸雨
难度: 简单查看答案及解析
-
下列说法不正确的是( )
①某种元素的相对原子质量取整数,就是其质量数
②同位素的性质完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥质子数相同的粒子一定是同种元素
A.②③⑤⑥ B.①②④⑤ C.③④⑤⑥ D.①②⑤⑥
难度: 简单查看答案及解析
-
根据元素周期表判断,下列叙述不正确是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原予的M层电子数相等
难度: 中等查看答案及解析
-
下列化学用语不正确的是( )
A.CO2分子的电子式为:
B.质子数为x,中子数为y的氧元素的核素符号为
C.Cl-的离子结构示意图为
D.HClO的结构式为H-Cl-O
难度: 中等查看答案及解析
-
下列有关金属的工业制法中,正确的是( )
A.制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
B.制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁
难度: 中等查看答案及解析
-
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O: 3CO+2NO2=3CO2+N2O。下列关于N2O的说法一定正确的是( )
A.上述反应中每生成1mol N2O,消耗67.2LCO
B.等质量的N2O和CO2含有相等的电子数
C.N2O只有氧化性,无还原性
D.上述反应中若有3 mol的CO被还原,则转移6NA个电子
难度: 中等查看答案及解析
-
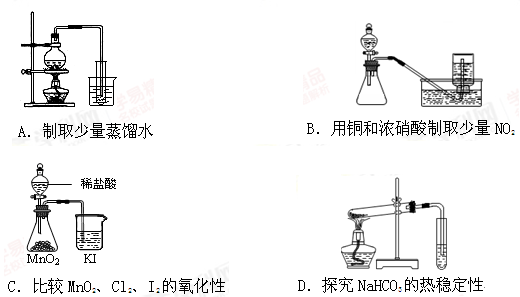
下列实验方案正确且能达到相麻实验预期目的是( )
难度: 中等查看答案及解析
-
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
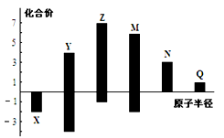
A.金属性:N>Q
B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X
D.原子序数:Z>M>Y>X
难度: 中等查看答案及解析
-
Se、Br两种元素的部分信息如图所示,下列说法正确的是( )
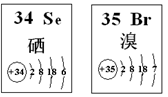
A.原子半径:Br>Se B.还原性:H2Se>HBr
C.Se在元素周期表中位于第四周期第六族 D.在Se2Br2分子中只含有极性键
难度: 中等查看答案及解析
-
关于离子键、共价键等化学键的下列叙述中正确的( )
A.在单质中一定不存在离子键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在离子化合物里,只存在离子键,没有共价键
D.化学键断裂一定伴随着化学变化
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )

A.原子半径: Z>W>X>Y
B.元素X、Y、Z、W的最高化合价分别与其主族序数相等
C.最简单气态氢化物的热稳定性:H2Y>XH3>WH3>ZH4
D.最高价氧化物对应水化物的酸性:HXO3>H3WO4>H2ZO3
难度: 中等查看答案及解析
-
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )

A.d和e分子中所有原子都不满足8电子结构 B.单质c的氧化性强于单质a
C.相同状况下,单质c、a、b的沸点逐渐减小 D.f可电离生成两种含10个电子的离子
难度: 中等查看答案及解析
-
硫酸铵在强热条件下分【解析】
4(NH4)2SO4=6NH3↑+N2↑+3SO2↑+SO3↑+7H2O。若将生成的气体全部通入氯化钡溶液中,得到的沉淀物是( )A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
难度: 中等查看答案及解析
-
RbH是一种离子化合物,它跟水反应的方程式为:RbH+H2O= RbOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是( )
A.灼烧RbH时,火焰有特殊颜色 B.RbH中H+半径比Li+半径小
C.跟液氨反应时,有RbNH2生成 D.在Na、K、Rb三种单质中,Rb的熔点最低
难度: 中等查看答案及解析
-
下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是

A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.保存少量的单质③时加少量水进行水封
D.单质④的氢化物在卤素氢化物中沸点最高
难度: 中等查看答案及解析
-
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
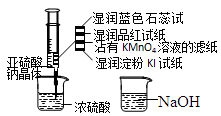
A.湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素
B.沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性
C.实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染
D.蓝色石蕊试纸先变红后褪色
难度: 中等查看答案及解析
-
下列有关资源综合利用的说法不正确的是( )
A.煤的气化、液化均为化学变化,而石油的常压蒸馏和减压蒸馏均是物理变化
B.绿色化学的核心就是利用化学原理吸收处理工业生产污染物并将其转化为有用物质
C.利用石油的裂化可以提高汽油的产量和质量
D.将苦卤水浓缩、氧化,鼓入空气和水蒸气可提取溴
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68 LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.100 mL B.45 mL C.10 mL D.15 mL
难度: 中等查看答案及解析