-
中华民族优秀的传统文化中蕴含许多化学方面的记载。下列说法合理的是
选项
古代文献
记载内容
涉及原理
A
《格物粗谈》
红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。
文中的“气”是指氧气
B
《本草经集注》
孔雀石(碱式碳酸铜)投入苦酒中,涂铁皆作铜色
该过程中涉及氧化还原反应
C
《鸽林玉露》
绳锯木断,水滴石穿
其中只涉及到物理变化,无化学变化
D
《开宝本草》
硝石(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成
利用KNO3的溶解度受温度影响不大的性质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业制备苯乙烯的原理:
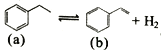 。下列关于a、b的说法错误的是
。下列关于a、b的说法错误的是A. 均属于苯的同系物 B. 所有碳原子均可能共平面
C. 一氯代物均有5种 D. 均可发生加成、取代反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
难度: 困难查看答案及解析
-
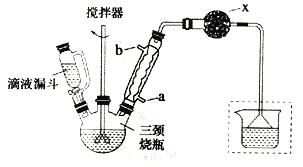
某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是
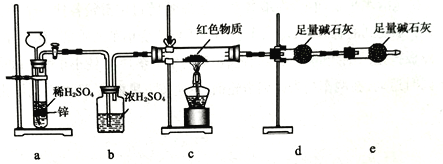
A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
难度: 中等查看答案及解析
-
下表是部分短周期主族元素的相关信息。下列说法错误的是
元素编号
元素性质或原子结构
X
周期序数=主族序数=原子序数
Y
原子最外层电子数为a,次外层电子数为b
Z
原子L层电子数为a+b,M层电子数为a-b
M
是地壳中含量最多的金属元素
W
位于第三周期,最外层电子数是电子层数的2倍
A. 上述五种元素分布在三个不同周期
B. 最简单氢化物的稳定性:Y>Z
C. M、W的最高价氧化物对应的水化物之间不能发生化学反应
D. Y、M、W分别形成的单核离子中,M形成的离子半径最小
难度: 中等查看答案及解析
-
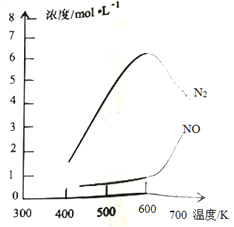
下图为光伏发电电解甲基肼[CH3-NH-NH2]制氢的装置示意图(电解池中交换膜仅阻止气体通过,a、b极均为惰性电极)。下列叙述中正确的是

A. N型半导体为正极,P型半导体为负极
B. 制氢装置溶液中电子从a极流向b极
C. 工作时,产生的N2、H2体积比为1:3(同温同压)
D. 工作时,a极的电极反应式为CH3-NH-NH2+12OHˉ-10eˉ=CO32-+N2↑+9H2O
难度: 困难查看答案及解析
-
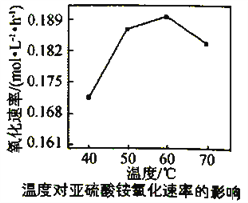
若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
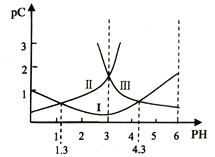
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
难度: 困难查看答案及解析
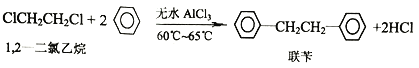
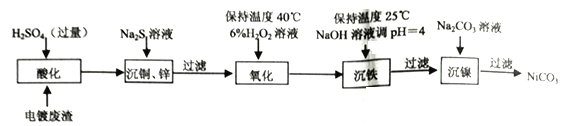
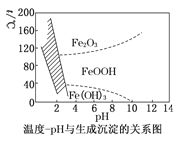
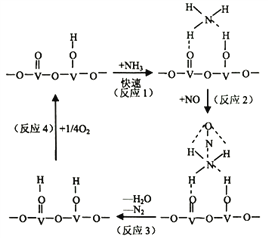
 )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下:

 有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________