-
化学与人类活动密切相关,下列有关说法正确的是( )
A. 加酶洗衣粉可以很好的洗涤毛织品上的污渍
B. 从花生中提取的生物柴油与由石油炼得的柴油都属于烃类物质
C. 用石灰水或MgSO4溶液喷涂在树干上均可消灭树皮上的过冬虫卵
D. 含氟牙膏能抑制口腔细菌产生酸,在一定程度上能防止或减少龋齿
难度: 简单查看答案及解析
-
下列选项中涉及的离子方程式书写正确的是( )
A. 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2OH-+2HCO
= CaCO3↓+CO
+2H2O
B. 室温下测得NH4HSO4溶液的pH<7,主要是因为存在:NH4++H2O
NH3·H2O+H3O+
C. 用重铬酸钾溶液滴定草酸:Cr2O
+14H++3C2O
-=2Cr3++6CO2↑+7H2O
D. 向AgCl沉淀中加入过量的氨水使AgCl溶【解析】
AgCl+2NH3·H2O = [Ag(NH3)2]++Cl-+2H2O难度: 中等查看答案及解析
-
某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
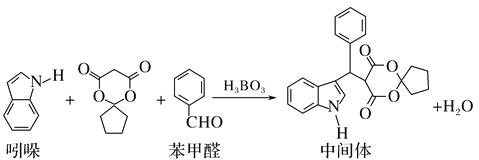
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
难度: 中等查看答案及解析
-
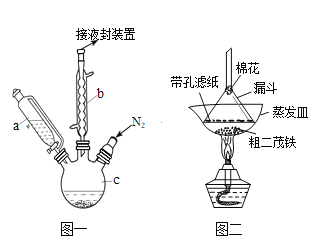
实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
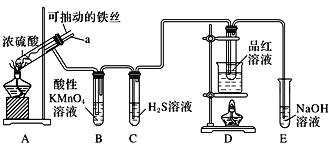
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+
C.装置D中品红溶液褪色可以验证SO2的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
难度: 中等查看答案及解析
-
根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
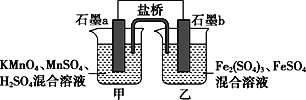
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
难度: 中等查看答案及解析
-
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )

A. Z和R所形成的化合物,不能通过溶液中复分解反应而制得
B. 简单离子的半径关系是:R>Y>Z>X
C. X和Y所形成的一种化合物,可用于自来水消毒
D. 工业上获得单质Z的方法,一般是通过电解其熔融氯化物来实现
难度: 中等查看答案及解析
-
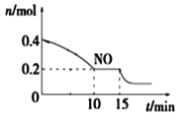
室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。下列说法正确的是( )
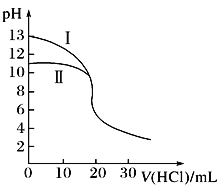
A. Ⅰ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(H+)>c(K+)>c(OH-)
D. 当滴定氨水消耗V(HCl)=10 mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析




 为原料制备
为原料制备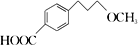 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _______________________
_______________________