-
下列有关说法错误的是
A.为保护海轮的船壳,常在船壳上镶入锌块
B.纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应
C.已知工业合成氨△H<O,达平衡后,升高温度,正反应速率减少、逆反应速率增大,平衡向逆反应方向移动.
D.NH3(g)+HCl(g)=NH4Cl(s)较低温下能自发进行,说明该反应的△H<O
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.过氧化钠的电子式:
B.次氯酸的结构式:H-Cl-O
C.氯化铵的电子式:
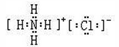
D.硫离子的结构示意图:
难度: 中等查看答案及解析
-
下表中物质的分类组合完全正确的是
选项
A
B
C
D
强电解质
HCl
BaSO4
HClO
KNO3
弱电解质
CaCO3
CH3COOH
HClO4
H2CO3
非电解质
Cl2
NH3
C2H5OH
H2O
难度: 简单查看答案及解析
-
下列实验操作和数据记录都正确的是
A. 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL
B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL
C. 用10mL量筒量取8.25mL盐酸
D. 用普通PH试纸测得某溶液PH为3:2
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A.Na+、OH-、HS-、NO3- B.AlO2-、K+、CO32-、Na+
C.Al3+、Cl-、HCO3-、Na+ D.Fe2+、K+、H+、NO3-
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是
A.1molFe溶于过量硝酸,电子转移数为2NA
B.1mol O2和2mol SO2反应生成的SO3分子数为2NA
C.常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA
D.H2O2分解产生1molO2,转移的电子数为4NA
难度: 困难查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ.mol-1
B.CO(g)的燃烧热是283.0 kJ/mol ,则CO2(g)=2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol
C.NaOH和HCl反应的中和热 △H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ/mol
难度: 困难查看答案及解析
-
如下图所示,△H1=-393.5kJ.mol-1, △H2=-395.4kJ.mol-1,下列正确的是
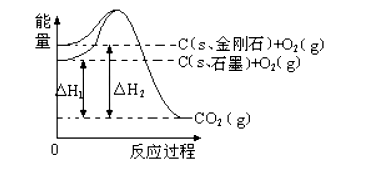
A.C(s、石墨)== C(s、金刚石) △H= +1.9 kJ·mol -1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
新能源汽车如(比亚迪秦、唐)相对传统汽车。有一系列的优点。如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒)。而新能源汽车一个核心部件为锂离子电池,下图是我国科学家报道的某种水溶液锂离子电池体系。下列叙述错误的是

A.a为电池的正极
B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
难度: 困难查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入He使体系压强增大
④保持压强不变,充入He使容器体积变大
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生如下反应:A(g)+3B(g)
2C(g);经3s后达到平衡,测得C气体的浓度为0.6mol﹒L-1,下列说法中正确的组合是
①用A表示反应的速率为0.1 mol﹒L-1﹒s-1
②用B表示反应速率为0.4 mol﹒L-1﹒s-1
③3s时生成C的物质的量为1.2mol
④3s时B的浓度为0.6mol﹒L-1
A.①②④ B.①③④ C.③④ D.②③④
难度: 中等查看答案及解析
-
下图表示可逆反应mA(g)+nB(s)
xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是
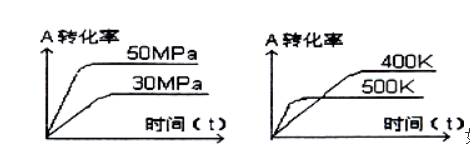
A.m>x,正反应为放热反应
B.m+n<x,正反应为吸热反应
C.m<x,正反应为放热反应
D.m>x,正反应为吸热反应
难度: 中等查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g)、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是:
A 反应①的正反应是吸热反应
B 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C 达平衡(I)时,X的转化率为5/11
D 在平衡(I)和平衡(II)中,M的体积分数相等
难度: 极难查看答案及解析
-
一定温度下,水存在H 2 O
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw 减小
B.将水加热,Kw 增大,pH增大
C.向水中加入少量固体HCl气体,平衡逆向移动,c(H+ )降低
D.向水中加入少量固体硫酸钠,c(H+ )和Kw 均不变
难度: 中等查看答案及解析
-
100mL6mol/L硫酸跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不能影响生成氢气的总量,可向反应物中加入适量的
①醋酸钠固体 ②水 ③硫酸钾固体 ④硝酸钾固体 ⑤固体铜
A.④⑤ B.①② C.①②③⑤ D.①②③④
难度: 中等查看答案及解析
-
室温下,有下列四种溶液:①0.1mol.L-1氨水,②0.1mol·L -1 NH 4 Cl溶液,③0.2mol·L -1 盐酸与0.2mol·L -1 NH 4 Cl溶液等体积混合,④0.2mol·L -1 NaOH溶液与0.2mol·L -1 氨水等体积混合,四种溶液中c(NH4+ )由大到小排列正确的是
A.②③④① B.④①②③ C.①④②③ D.③②①④
难度: 中等查看答案及解析
-
已知常温下浓度均为0.1mol/L的下列三种溶液的PH:
溶质
NaHCO3
Na2CO3
NaCN
PH
9.7
11.6
11.1
下列说法中正确的是
A.溶液中阳离子的物质的量浓度之和:Na 2CO3 >NaCN>NaHCO3
B.相同条件下的酸性:H 2CO3 <HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na 2CO3 溶液的温度,
减小
难度: 中等查看答案及解析
-
已知Ksp(AgCl) = 1.56 × 10-10, Ksp(AgBr) = 7.7 × 10-13,Ksp(Ag2CrO4) = 9.0× 10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42-
D.Br-、CrO42-、Cl-
难度: 中等查看答案及解析
-
pH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是
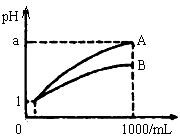
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
向10.0mL0.10mol·L-1氨水中滴入10 mL0.1 mol·L-1盐酸,溶液的PH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是
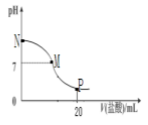
A.M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.PH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+)
D.p点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl-)
难度: 中等查看答案及解析
-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入CO2气体,只能生成HX和NaHCO3;向NaY溶液中通入CO2,只生成HY和Na2CO3.下列有关叙述正确的是
A.酸性由强到弱:HX>HY>H2CO3
B.结合H+的能力:Y->CO32->X->HCO3-
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.向NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(OH-)>c(X-)
难度: 困难查看答案及解析
-
在Na2S溶液中下列关系不正确
A.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-)
D.c(OH-)=c(H+)+c(HS-)+c(H2S)
难度: 中等查看答案及解析
-
下表是五种银盐的浓度积常数(25℃),下列有关说法错误的是
化学式
AgCl
Ag 2SO 4
Ag2 S
AgBr
AgI
溶度积
1.8×10 -10
1.4×10 -5
6.3×10 -50
7.7×10 -13
8.5×10 -16
A.五种物质在常温下溶解度最大的是Ag 2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
难度: 中等查看答案及解析
-
T℃时。体积均为0.5L的两个恒容密闭容器中发生可逆反应:
2A(g)+B(g)
2C(g)△H=-QkJ/mol(Q>0)
实验测得反应在起始、达到平衡时的有关数据如下表:
容器编号
起始时各物质物质的量/mol
达到平衡时体系能量的变化
A
B
C
①
2
1
0
0.75Q kJ
②
0.4
0.2
1.6
下列叙述正确的是
A.容器①、②中反应的平衡常数均为36
B.容器②中反应达到平衡时放出的热量为0.05 Q kJ
C.向容器①中通入氦气,平衡时A的转化率不变
D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
难度: 困难查看答案及解析
