-
下列有关有机物结构、性质的分析正确的是
A. 苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色
B. 乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键
C. 乙醇、乙酸均能与 Na 反应放出 H 2 ,二者分子中官能团相同
D. 乙醇在铜催化作用下,能发生还原反应生成乙醛
难度: 中等查看答案及解析
-
下列物质属于混合物的是
A. 冰醋酸 B. 石油裂解气 C. 硫磺 D. 酒精
难度: 简单查看答案及解析
-
干冰气化时,发生变化的是
A. 分子间作用力 B. 分子内共价键
C. 分子的大小 D. 分子的化学性质
难度: 中等查看答案及解析
-
为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须
A. 除去铁锈 B. 用盐酸清洗 C. 彻底干燥 D. 加点铁粉
难度: 中等查看答案及解析
-
下列烷烃命名错误的是
A. 2─甲基戊烷 B. 3─乙基戊烷
C. 3,4─二甲基戊烷 D. 3─甲基己烷
难度: 中等查看答案及解析
-
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是
A. 氯气 B. 二氧化碳 C. 氯化钾 D. 醋酸钠
难度: 中等查看答案及解析
-
下列变化过程中Q>0的是
A. CH3COOH
CH3COO- + H+ + Q
B. CaCO3(s)→ CaO(s)+ CO2(g)+ Q
C. S2- + H2O
HS- + OH- + Q
D. S(g)→S(l)+ Q
难度: 中等查看答案及解析
-
铁棒与石墨用导线连接后,浸入0.01mol·L-1的食盐溶液中(如图所示),下列说法正确的是

A. 铁棒是阴极 B. 石墨附近产生OH-
C. 石墨上有Cl2 放出 D. 铁棒上有H2放出
难度: 中等查看答案及解析
-
下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是
A. 观察颜色 B. 加热 C. 加水 D. 加紫色石蕊试液
难度: 中等查看答案及解析
-
标准状况下的1mol N2和1mol13C2H2,下列叙述错误的是
A. 质量相等 B. 体积相等 C. 质子数相等 D. 共用电子对数目相等
难度: 中等查看答案及解析
-
下列变化不能通过一步反应直接完成的是
A. Na→Na2O2 B. C→CO2 C. S→SO3 D. Fe→Fe3O4
难度: 中等查看答案及解析
-
测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的
A. 蒸发皿 B. 研钵 C. 干燥器 D. 坩埚
难度: 中等查看答案及解析
-
与实际化工生产功能相符合的化学方程式是
A. 工业制取乙烯: C2H5OH
CH2=CH2↑+H2O
B. 工业合成盐酸:H2 + Cl2
2HCl
C. 工业获取氯化钠:2Na + Cl2
2NaCl
D. 工业制漂粉精:2Ca(OH)2+2Cl2 → Ca(ClO)2+CaCl2+2H2O
难度: 中等查看答案及解析
-
如图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
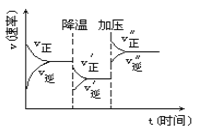
A. 正反应是放热反应
B. A、B一定都是气体
C. D一定不是气体
D. C可能是气体
难度: 困难查看答案及解析
-
下列物质之间进行反应时,可用离子方程式2H+ + CO32- → H2O+CO2 ↑表示的是
A. 碳酸钠溶液中加入足量醋酸溶液 B. 碳酸钡和稀硝酸反应
C. 碳酸氢钠溶液中加入少量稀硫酸 D. 在盐酸溶液中滴入少量碳酸钾溶液
难度: 中等查看答案及解析
-
将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色。此过程中二氧化硫表现出
A. 酸性 B. 还原性 C. 氧化性 D. 漂白性
难度: 中等查看答案及解析
-
常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法错误的是
A. 反应后HA溶液可能有剩余
B. HA溶液和NaOH溶液的体积可能相等
C. 溶液中c(Na+)>c( A—)
D. HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等
难度: 困难查看答案及解析
-
根据相关化学原理,下列判断正确的是:
A. 若R
和M
的电子层结构相同,则原子序数: M> R
B. 若R
和M
的电子层结构相同,则离子半径:M
>R
C. 若X是原子晶体,Y是分子晶体,则熔点:Y>X
D. 若A2+2D—→2A-+D2,则氧化性:D—>A-
难度: 困难查看答案及解析
-
下列各组离子,能在同种溶液中大量共存的是
A. NH4+、Na+、OH-、SO42- B. NH4+、Mg2+、NO3- 、Cl-
C. Ba2+、OH-、Cl-、SO42- D. Fe2 +、H+ 、Cl- 、NO3-
难度: 中等查看答案及解析
-
在0.1 mol/L Na2CO3溶液中,微粒间浓度关系正确的是
A. [Na+] + [H+]=[OH—] + [HCO3—] + [CO32—]
B. [Na+]>[CO32—]>[HCO3—]>[OH—]
C. [Na+]=2[CO32—] + 2[HCO3—] + 2[H2CO3]
D. [Na+]>[HCO3—]>[CO32—]>[OH—]
难度: 中等查看答案及解析