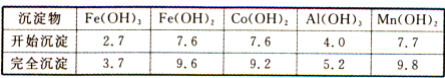
-
化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏和煤的液化均是物理变化
B.天然纤维和合成纤维的主要成分都是纤维素
C.海水淡化的方法有蒸馏法、电渗析法等
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法中正确的是
A.一定条件下,2.3g Na与O2完全反应生成3.6 g产物时失去的电了数为0.1NA
B.在密闭容器中加入1.5 mol H2和0.5mol N2,充分反应后可得到NH3的分子数为NA
C.1.0 L 0.1mol·L-1Na2S溶液中含有的S2-为0.1NA
D.标准状况下,22.4 LCCl4中含有的CCl4的分子数为NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.NH4HCO3溶液中加入少量稀NaOH溶液:
+OH-═NH3·H2O
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br一+2CI2═2Fe3++Br2+4CI一
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O
D.Ba(OH)2溶液中加过量Al2 (SO4)3溶液:3Ba2++6OH一+2AI3++3S
═3BaSO4↓+2AI(OH)3↓
难度: 中等查看答案及解析
-
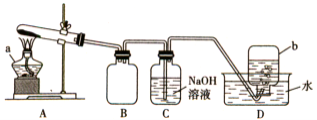
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是 ( )

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
难度: 极难查看答案及解析
-
下列实验能达到预期目的的是
选项
实验内容
实验目的
A
测同温同浓度下的Na2CO3和Na2SO3水溶液的pH
确定碳和硫两元素非金属性强弱
B
取一定质量的铝片,与过量的NaOH溶液充分反应,逸出的气体通过硅胶后,测其体积
确定铝片中氧化铝的含量
C
取久置的Na2SO3溶于水,加硝酸酸化的BaCl2溶液
证明Na2SO3部分被氧化
D
向CH2═CHCH2OH中滴加酸性KMnO4溶液
证明CH2═CHCH2OH中含有碳碳双键
难度: 中等查看答案及解析
-
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2 (g)-
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1 L的恒容密闭容器中充入l mol CO2和3 mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图F6-2所示,且平衡时体系压强为p1。下列叙述中不正确的是 ( )
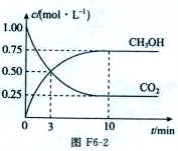
A.0~3 min内,v(CO2) 正=v(CH3OH)正
B.在T1℃时,若起始时向容器中充人2 moI CO2和6 mol H2,测得平衡时容器内压强为p2,则p2<2p1
C.其他条件不变,若向平衡后的体系中充人1 mol氦气,体系压强增大,平衡将向正反应方向移动
D.T2℃时,上述反应平衡常数为4.2,则T2>T1
难度: 极难查看答案及解析
-
常温下,用0.1 mol.L-1HCl溶液滴定10.0 mL浓度为0.1 mol.L-1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是 ( )
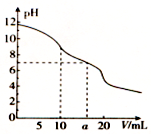
A.当V=0时:c( H+) +c( HCO3-)+c( H2 CO3) =c(OH-)
B.当V=5时:c(CO32-) +c(H
)+c( H2CO3) =2c(Cl一)
C.当v=10时:c( Na+) >c( HCO3) > c(CO32-)>c( H2CO3)
D.当V=a时:c(Na+)=c(Cl一)>c(H+)=c(OH一)
难度: 困难查看答案及解析