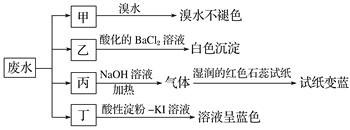
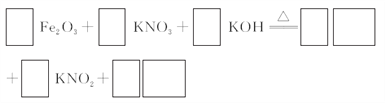
-
根据表中信息判断,下列选项不正确的是( )
序列
参加反应的物质
生成物
①
KMnO4 、H2O2 、H2SO4
K2SO4 、MnSO4 ……
②
Cl2 、FeBr2
FeCl3 、FeBr3
③
MnO4- ……
Cl2 、Mn2+ ……
A. 第①组反应的其余产物为H2O和 O2
B. 第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C. 第③组反应中生成1mol Cl2,转移电子2mol
D. 氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
难度: 困难查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是
A. 这个反应是氧化还原反应 B. 制造过程中元素种类没有改变
C. 另一种化合物为NaCl D. 金刚石属于碳的一种同位素
难度: 中等查看答案及解析
-
下列对化学知识概括合理的是
A. 酸性氧化物都是非金属氧化物
B. 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C. 丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
D. 只有非金属能形成含氧酸或含氧酸盐
难度: 简单查看答案及解析
-
下列物质按纯净物、混合物、电解质、非电解质的顺序正确的一组为
A. 盐酸、空气、硫酸、干冰 B. 蒸馏水、氨水、碳酸氢钠、二氧化硫
C. 胆矾、盐酸、铁、碳酸钙 D. 生石灰、漂白粉、氯化铜、氧化铝
难度: 简单查看答案及解析
-
下列说法正确的是
A. 酸化高锰酸钾溶液时可以用盐酸酸化
B. 金属钠着火时不能用泡沫灭火器灭火
C. 氢氧化铁胶体的电泳实验,证明了氢氧化铁胶体带电荷
D. 能与碱反应生成盐和水的氧化物一定是酸性氧化物
难度: 简单查看答案及解析
-
已检测出pH=1的某未知溶液中含有Al3+和NO3-,检验此溶液中是否大量存在以下6种离子:①ClO- ②NH
③Fe2+ ④K+ ⑤HCO
⑥Cl-,其中不必检验即可否定的离子是
A. ①③⑤ B. ②③④ C. ①②⑥ D. ④⑤⑥
难度: 简单查看答案及解析
-
如图是氨气与氯化氢反应的装置。抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
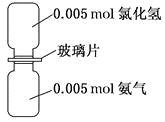
A. 气体反应物的总体积为0.224 L
B. 生成物的分子个数为0.005NA
C. 生成物中的N—H键个数为0.02NA
D. 加水溶解后所得溶液中NH4+数目为0.005NA
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移电子总数为0.1mol
B. 海水提镁和海水提溴都涉及氧化还原反应
C. 向Na2CO3溶液中滴加盐酸溶液,一定有CO2气体生成
D. Na2O2常用于潜水艇或呼吸面具的供氧剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数为0.4 NA
D. 常温下56 g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 简单查看答案及解析
-
下列离子在指定条件下能大量共存的是
A. c(I-)=0.1 mol/L的溶液中:Ca2+、NO3-、Fe3+、Cl-
B. SO2饱和溶液中:NH4+、K+、CO32-、ClO-
C. 放入镁带有气体逸出的溶液中:Na+、K+、Cl-、SO42-
D. 常温下水电离出c(H+)=1×10-10 mol/L的溶液中:NH4+、Na+、S2-、CH3COO-
难度: 中等查看答案及解析
-
配制一定物质的量浓度硫酸时,下列情况会使所配溶液浓度偏低的是
A. 容量瓶中原有少量的水
B. 用量筒量取浓硫酸时,俯视读数
C. 洗涤量取浓硫酸的量筒,把洗涤液转入容量瓶
D. 定容时,俯视容量瓶的刻度线
难度: 中等查看答案及解析
-
向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
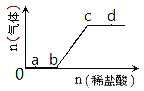
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
C. b点对应的溶液中:Al3+、Fe3+,MnO4-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是
A. 物质的量相等的溴化亚铁跟氯气反应 2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
B. Ca(HCO3)2溶液中加入足量NaOH:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C. 向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-===2A1(OH)3↓ +3BaSO4↓
D. 向碳酸钠溶液中滴加过量的稀硫酸: CO32- + 2H+ = CO2↑+ H2O
难度: 简单查看答案及解析
-
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
Ⅰ
Ⅱ
A
将少量SO2通入Ba(OH)2溶液
将过量SO2通入少量Ba(OH)2溶液
B
将少量NaHSO4溶液滴入Na2CO3溶液
将少量Na2CO3溶液滴入NaHSO4溶液
C
将0.1mol Cl2通入含0.2molFeBr2的溶液
将0.3mol Cl2通入含0.2mol FeBr2的溶液
D
将浓氨水滴入Al2(SO4)3溶液
将Al2(SO4)3溶液滴入浓氨水
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
硫酸 化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g/cm3
质量分数:98%
A. 该试剂的物质的量浓度为9.2 mol·L-1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C. 配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
难度: 中等查看答案及解析
-
如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是
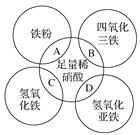
A.Fe+4H++NO
===Fe3++NO↑+2H2O
B.Fe3O4+8H+===Fe2++2Fe3++4H2O
C.Fe(OH)3+3H+===Fe3++3H2O
D.3Fe(OH)2+10H++NO
===3Fe3++NO↑+8H2O
难度: 简单查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
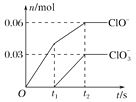
A. 反应中转移电子的物质的量是0.21 mol
B. ClO
的生成可能是由于温度升高引起的
C. 标准状况下有3.36 L氯气参加反应
D. 苛性钾溶液中KOH的物质的量为0.2 mol
难度: 简单查看答案及解析
-
用0.2 mol/L Na2SO3溶液32 mL,还原含2×10-3 mol X2O72-的溶液,过量的Na2SO3用0.1 mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6 mL,则元素X在还原产物中的化合价是
A. +3 B. +4 C. +5 D. +6
难度: 中等查看答案及解析
-
0.2 mol Na
O2与足量CO2完全反应后,下表对生成物Na2CO3和O2的描述中正确的是
Na2CO3的质量
关于O2的描述
A
21.2 g
O2的摩尔质量是36 g·mol-1
B
21.6 g
生成标准状况下O2的体积为2.24 L
C
21.6 g
O2的摩尔质量是34 g·mol-1
D
22.4 g
生成标准状况下O2的体积为2.24 mL
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的气体x(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
A. 0.3mol NO2和0.3mol NO
B. 0.2mol NO2和0.1mol N2O4
C. 0.6mol NO
D. 0.1mol NO、0.2mol NO2和0.05mol N2O4
难度: 中等查看答案及解析