-
X、Y、Z、W是四种不同的金属,为比较金属活动性的强弱,某同学利用这四种金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能发生置换反应的记为“√”,不能反应的记为“一”,无标记的表示未做该实验).这四种金属的活动性顺序为( )
X Y Z W 盐酸 √ - - √ Z的硝酸盐 √ W的硝酸盐 √ -
A.Y>W>Z>X
B.X>Y>W>Z
C.W>X>Y>Z
D.X>W>Y>Z难度: 中等查看答案及解析
-
下列实验操作错误的是( )
A.稀释浓硫酸时,将浓硫酸沿容器壁慢慢倒入水中并搅拌
B.向烧杯中滴加液体时,滴管不能接触烧杯内壁
C.为加快固体在水中的溶解,用温度计轻轻地进行搅拌
D.为防止液体加热沸腾后冲出试管伤人,用橡皮塞塞紧试管后再加热难度: 中等查看答案及解析
-
下列各选项中的三种固体通过分别加水就能加以鉴别的是( )
A.氯化钠、硝酸铵、氢氧化钠
B.氯化钠、硫酸钠、硫酸钡
C.氢氧化钠、氢氧化钾、氢氧化钡
D.氯化钠、硫酸钡、无水硫酸铜难度: 中等查看答案及解析
-
在一定温度下,向足量的饱和碳酸钠溶液中加入1.06g无水碳酸钠,搅拌静置后,最终所得晶体的质量是( )
A.等于1.06g
B.等于2.86g
C.大于2.86g
D.大于1.06g,小于2.86g难度: 中等查看答案及解析
-
三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”.士兵们饮后致哑、腹痛,甚至死亡.又有一“安乐泉”,与“哑泉”混合后可解“哑泉”之毒.1995年10月,国内某刊报道,经研究“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性.下列有关说法符合题意的是( )
A.“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2OH-=Cu(OH)2↓
B.“哑泉”之毒是由于CuSO4与水反应后,溶液呈较强的酸性;
C.“安乐泉”能解“哑泉”之毒的离子方程式为H++OH-=H2O
D.以上选项均不正确难度: 中等查看答案及解析
-
下列物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;BaO2叫过氧化钡;KO2叫超氧化钾.试综合上述命名规律,分析思考后回答:K2CS3应读作( )
A.过硫碳酸钾
B.多硫碳化钾
C.三硫代碳酸钾
D.超硫碳酸钾难度: 中等查看答案及解析
-
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④生石灰( )
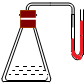
A.①②④
B.①②③
C.②③
D.③④难度: 中等查看答案及解析
-
同温同压下,1体积氮气和3体积氢气化合生成2体积氨气.已知氮气和氢气都由最简单分子构成,推断他们都是双原子分子和氨的化学式的主要依据是( )
①阿伏加德罗定律;②质量守恒定律;③原子或分子只能为整数;④化合价原则.
A.①③
B.①②③
C.①②④
D.①②③④难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.92gNO2和N2O4混合气体中含有的原子数为6NA
B.标准状况下,22.4L水中含有的分子数为NA
C.0.5mol/L的Ba(OH)2溶液中OH-的数目为NA
D.1.7gH2O2中含有的电子数为0.9NA难度: 中等查看答案及解析
-
某学生用下列溶液配制一种混和液,已知配成的溶液中各种离子的浓度如下:2c(K+)=2c(Cl-)=c(Na+)=2c(SO42-),则配制该溶液使用的盐可能是( )
A.KClNa2SO4
B.NaClK2SO4
C.NaClNa2SO4K2SO4
D.KClNa2SO4K2SO4难度: 中等查看答案及解析
-
两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是( )
A.质子总数
B.质量
C.密度
D.原子总数难度: 中等查看答案及解析
-
某无色溶液中,可能含Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种,取样后向其中滴加NaOH溶液,溶液中出现沉淀;另取样加入稀H2SO4也出现白色沉淀,并放出气体.据此分析,下列判断中正确的是( )
①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有Na2CO3 ⑤肯定没有MgCl2.
A.①②③
B.②④
C.①③⑤
D.①③难度: 中等查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是( )
A.p=(17V+22400)/(22.4+22.4V)
B.W=17c/(1000ρ)
C.W=17V/(17V+22400)
D.C=1000Vρ/(17V+22400)难度: 中等查看答案及解析
-
有三种不同浓度的稀硫酸,体积比依次为3:2:1,它们分别与等物质的量的K2CO3、KHCO3、Al刚好完全反应,此三种硫酸的物质的量的浓度比为( )
A.1:1:1
B.6:2:3
C.4:3:18
D.2:1:3难度: 中等查看答案及解析
-
有一包不纯的Na2CO3样品,其中只含一种杂质,现取该样品5.3g与足量稀盐酸反应生成2.4g CO2,则所混杂质可能是( )
A.BaCO3
B.K2CO3
C.CaCO3
D.MgCO3难度: 中等查看答案及解析
-
50mlBaCl2溶液和20ml0.5mol/L的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中的Cl-的物质的量浓度为( )
A.0.1mol/L
B.0.2mol/L
C..0.8mol/L
D.1mol/L难度: 中等查看答案及解析
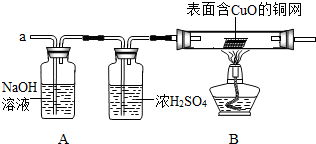
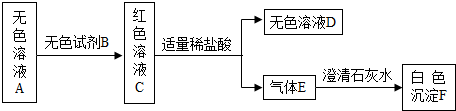
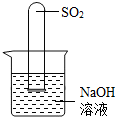 ______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.
______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.