-
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于
Y的说法错误的是( )
A. 属于金属元素
B. 质子数与中子数之差为50
C. 原子的核外电子数是39
D.
Y和
Y 是两种不同的核素
难度: 简单查看答案及解析
-
下列化学用语书写错误的是( )
A. 原子核内有10个中子的氧原子:
B. 磷的原子结构示意图:

C. CCl4电子式:
D. 水的电子式:
难度: 简单查看答案及解析
-
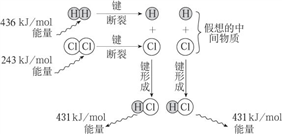
下列反应中,属于吸热反应的是( )
A. 燃烧CO B. NaOH溶液和稀盐酸反应
C. 铝和稀盐酸反应 D. Ba(OH)2•8H2O晶体和NH4Cl晶体反应
难度: 简单查看答案及解析
-
下列有关叙述中,不正确的是( )
A. SiO2可用作制备光导纤维
B. Na、K合金熔点比任何一个组分低
C. 通过化学反应可实现12C到14C的转化
D. 晶体硅可用于制作太阳能光板、制造芯片
难度: 简单查看答案及解析
-
等质量镁铝合金分别与下列四种过量的溶液充分反应,放出H2最多的是( )
A. H2SO4溶液 B. NaOH溶液 C. 蔗糖溶液 D. NaCl溶液
难度: 中等查看答案及解析
-
制备硅单质时,主要化学反应如下:
①SiO2 + 2C
Si + 2CO↑
② Si + 2Cl2
SiCl4
③SiCl4 + 2H2
Si + 4HCl
下列对上述三个反应的叙述中,不正确的是
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被还原
难度: 中等查看答案及解析
-
具有相同的电子层结构的短周期元素离子:aA2+、bB+、cC3﹣、dD﹣,下列叙述正确的是( )
A. 原子序数 d>c>b>a B. 单质的还原性 A>B>D>C
C. 原子半径 B>A>C>D D. 离子半径 D>C>B>A
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层8电子结构的是( )
A. PCl5 B. H2O C. CO2 D. LiF
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析
-
已知A、B、C、D、E是原子序数依次增大的5种短周期元素,其中只有2种金属元素,A、C同主族,B最外层电子数是电子层数三倍,E元素的最高正化合价与最低负化合价的代数和为6,C、D、E的最高价氧化物的水化物之间能相互反应。下列说法正确的是( )
A. A可能为H或Li
B. A和其他4种元素均能形成共价化合物
C. C和其他元素中的3种元素均能形成离子化合物
D. 5中元素中最高价氧化物酸性最强的物质为H2EO4
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 共价化合物内部可能有离子键
B. 原子或离子间相互吸引叫化学键
C. 全部由非金属元素组成的化合物不一定是共价化合物
D. 第IA主族元素与第VIIA元素一定形成离子键
难度: 中等查看答案及解析
-
下列各组物质中,化学键的类型完全相同的是( )
A. MgCl2和Na2S B. Na2O和Na2O2 C. N2和HCl D. NaCl和NaOH
难度: 简单查看答案及解析
-
下列变化化学键未被破坏的是( )
A. Cl2溶于水 B. NaCl固体熔化 C. H2与Cl2反应 D. 干冰气化
难度: 中等查看答案及解析
-
下列对“化学反应速率”的理解正确的是( )
A. 化学反应速率可以用单位时间内反应物浓度的减少量来表示
B. 增大压强一定能加快反应速率
C. 决定一个反应的快慢本质原因是反应体系的温度
D. 使用催化剂一定加快反应速率
难度: 简单查看答案及解析
-
在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol•L-1•s-1 B. v(B)=0.3mol•L-1•s-1
C. v(C)=48mol•L-1•min-1 D. v(D)=1.0mol•L-1•min-1
难度: 中等查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是
A. ①④ B. ③④ C. ①②③ D. ②③
难度: 中等查看答案及解析
-
在铝制易拉罐中收集一满罐CO2,加入过量浓NaOH溶液,立即把口封闭。发现易拉罐“咔咔”作响,并变瘪了;过一会儿后,易拉罐又会作响并鼓起来。则下列说法错误的是( )
A. 导致易拉罐变瘪的反应是:CO2 + 2OH-= CO32-+ H2O
B. 该过程易拉罐内共发生了2个反应
C. 取易拉罐内反应后的溶液,逐滴加入足量的盐酸,最终会产生沉淀
D. 如果将CO2换为NH3,浓NaOH溶液换为浓盐酸,易拉罐也会出现先瘪后鼓的现象
难度: 困难查看答案及解析
-
下列各图中的纵坐标表示沉淀的物质的量,横坐标表示加入的物质的量,符合“在Na[Al(OH)4]溶液中通入HCl气体”的图像是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析