-
下列说法中,正确的是
A.KOH的摩尔质量是56g B.一个碳原子的质量就是其相对原子质量
C.硫原子的质量就是硫的相对原子质量
D.氦气的摩尔质量在数值上等于它的相对原子质量
难度: 简单查看答案及解析
-
用NA表示阿佛加德罗常数,下列说法中正确的是

A.1mol甲烷的质量与NA个甲烷分子的质量之和相等
B.28g氮气与40g氩气所含的原子数目相等,都是NA个
C.2.3g钠由原子变成离子,失去的电子数为0.1NA
D.18g重水(D2O)所含的电子数为10NA
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.20 g重水(D2O)中含有的电子数为10NA
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法正确的是
A.0.5molAl与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2LSO3所含的分子数为0.5NA
C.0.1molCH4所含的电子数为1NA
D.46gNO2和N2O4的混合物含有的分子数为1NA
难度: 简单查看答案及解析
-
NA 代表阿伏加德罗常数,下列叙述错误的是
A. 10 mL 质量分数为 98 %的 H2SO4 ,用水稀释至 100 mL , H2SO4 的质量分数为 9.8 % B. 在 H2O2 + Cl2 = 2HCl + O2 反应中,每生成 32g氧气,则转移 2 NA 个电子
C .标准状况下,分子数为NA的 CO 、C2H4 混合气体体积约为 22 . 4L ,质量为 28g
D .一定温度下, 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含NH4+ 物质的量不同
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
难度: 简单查看答案及解析
-
下列说法不正确的是
A.1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L
B.1mol臭氧和1.5mol氧气含有相同的氧原子数
C.等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是
A 常温下11.2L的甲烷气体含有甲烷分子数为0.5NA个
B 14g乙烯和丙烯的混合物中总原子数为3NA个
C 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D 5.6g铁与足量的稀硫酸反应失去电子数为0.3NA个
难度: 简单查看答案及解析
-
下列叙述正确的是
A 48gO3气体含有6.02×1023个O3分子
B 常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C 0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D 标准状况下,33.6LH2O含有9.03×1023个H2O分子
难度: 简单查看答案及解析
-
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.23gNa在氧气中完全燃烧失电子数为0.5NA
B.1L2mol·L-1的MgCl2溶液中含Mg2+数为2NA
C.标准状况下,11.2LSO3所含分子数为0.5NA
D.室温下,8g甲烷含有共价键数为2NA
难度: 简单查看答案及解析
-
设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有nA个C12分子
B.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 nA个Na+
C.1 mol H2与1 mol C12反应生成nA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2nA
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数,下列叙述正确的是
A. 24g镁的原子量最外层电子数为NA B. 1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C. 1mol甲烷分子所含质子数为10NA D. 标准状况下,22.4L乙醇的分子数为NA
难度: 简单查看答案及解析
-
设nA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
A. 1 mol 硫酸钾中阴离子所带电荷数为nA
B. 乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3nA 个氢原子
C. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA
难度: 简单查看答案及解析
-
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的
沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.
B.
C.n=m+17Vc D.
<
<
难度: 简单查看答案及解析
-
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
难度: 简单查看答案及解析
-
9.2g金属钠投入到足量的重水中,则产生的气体中含有
A.0.2mol中子 B.0.4mol电子
C.0.2mol质子 D.0.4mol分子
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.常温下,
溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4
中含N—H键数目为
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 25℃时,PH=13的1.0L Ba(OH)2溶液中含有的
数目为0.2NA
B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C. 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D. 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
难度: 简单查看答案及解析
-
有一真空储气瓶,净重500克。在相同条件下,装满氧气后重508克,装满另一种气体X时重511克,则X的相对分子质量为( )
A. 44 B. 48 C. 64 D. 71
难度: 简单查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生
气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
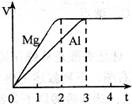
A.物质的量之比为3:2 B.质量之比为3:2
C.摩尔质量之比为2:3 D.反应速率之比为2:3
难度: 简单查看答案及解析
-
实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所
得固体中含金属单质为18g,则该氧化物粉末可能是
A.
B.
和
C.
和
D
和FeO
难度: 简单查看答案及解析
-
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的Na2CO3质量分别为( )
A. 1000mL , 212g B. 950mL , 201.4g C. 500mL , 286g D. 1000mL, 201.4g
难度: 简单查看答案及解析
-
浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A.1 B . 2 C . 3 D. 4
难度: 简单查看答案及解析
-
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
难度: 简单查看答案及解析
-
在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是
A AB B A2B3 C AB2 D AB3
难度: 简单查看答案及解析
-
在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体
的体积是
A. 6.72 L B. 7.84 L C.10.08 L D.13.44 L
难度: 简单查看答案及解析
-
将15ml.2mol•.
溶液逐滴加入到40 ml.0.5mol•.
盐溶液中,恰好将溶液中的
离子完全沉淀为碳酸盐,则
中n值是

A. 4 B. 3 C. 2 D. 1
难度: 简单查看答案及解析
-
已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3
C.1∶4 D.2∶3
难度: 简单查看答案及解析
-
1 mol HO 与足量的NaOH
溶液充分反应,消耗的NaOH的物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
难度: 简单查看答案及解析
-
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反
应的离子方程式,其中不正确的是

A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
难度: 简单查看答案及解析
-
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2 mol·L-1 H2SO4溶液 B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液 D.3mol·L-1HNO3溶液
难度: 简单查看答案及解析
-
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A 若管道漏气遇氨就会产生白烟 B 该反应利用了Cl2的强氧化性
C 该反应属于复分解反应 D 生成1molN2有6mol电子转移
难度: 简单查看答案及解析
-
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这
三种气体的压强(P)从大到小的顺序是

A.P(Ne)>P(H2)>P(O2) B.P(O2)>P(Ne)>P(H2)
C.P(H2)>P(O2)>P(Ne) D.P(H2)>P(Ne)>P(O2)
难度: 简单查看答案及解析
-
已知氧化还原反应: 2Cu(IO3)2 +24KI +12H2SO4=2CuI↓+13I2 +12K2SO4 +12H2O
其中1mol氧化剂在反应中得到的电子为
A.10mol B.11mol C.12mol D.13mol
难度: 简单查看答案及解析
