-
铝硅合金具有熔点低、凝固时收缩率小等优点,适合铸造。现取试样10.0 mg,放在纯净氧气中完全燃烧,燃烧后的固体经称量发现比原来试样增重9.23 mg,由此计算硅铝合金中硅的质量分数为
A.12.3% B.15.4% C.13.4% D.17.0%
难度: 中等查看答案及解析
-
在日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
A.元素 B.单质 C.分子 D.氧化物
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数值,下列说法正确的是
A.78gNa2O2所含有的离子数为3NA
B.1mol甲基中含有电子数为10NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1molC10H22分子中共价键总数为22NA
难度: 中等查看答案及解析
-
标况下,两个容积相同的容器中,一个盛有NH3气体,另一个盛有N2和H2的混合气体。若两容器内的气体具有相等的电子数,则混合气体中N2和H2的物质的量之比为
A.4:1 B.1:2 C.2:1 D.1:4
难度: 中等查看答案及解析
-
下列化学方程式中,不能用离子方程式H++OH—=H2O表示的是
A. HCl+NaOH=NaCl+H2O B.Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
C.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O D.NaOH+NaHSO4=Na2SO4+H2O
难度: 中等查看答案及解析
-
下表中物质的分类组合完全正确的是
编号
A
B
C
D
强电解质
Ba(OH)2
盐酸
HClO4
BaSO4
弱电解质
HI
CaCO3
HClO
NH3·H2O
非电解质
SO2
NH3
Cl2
乙醇
难度: 中等查看答案及解析
-
既能与盐酸又能与氢氧化钠溶液反应,且生成物中均有气体产生的物质是
A.Al(OH)3 B.NaAlO2 C.AlCl3 D.Al
难度: 中等查看答案及解析
-
在VmLAl2(SO4)3溶液中含有Al3+m g, 取V/4mL该溶液用水稀释至4VmL,则SO42- 的物质的量浓度为
A.125m / 9V mol/L B.125m / 36V mol/L
C.125m / 54V mol/L D.125m / 18V mol/L
难度: 中等查看答案及解析
-
高铁酸钾(KFeO4)是一种新型、高效、多功能水处理剂。下列反应可制取KFeO4:2Fe(OH)3+3Cl2+10KOH
2KFeO4+6KCl+8H2O,对于该反应下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生还原反应 D.Cl2是氧化剂
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1 ,下列说法中正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属
B.l mol C22H46中含有的C—C键个数约为21×6.02×1023
C.0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023
D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023
难度: 困难查看答案及解析
-
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是

A.该装置实现化学能向电能的转化
B.该电池的总反应为2NO + O2 = 2NO2
C.NiO电极的电极反应式: NO + O2- - 2e— = NO2
D.当有2.24L的O2参与反应时,转移了0.4mole—
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 L氧气中所含有的原子数为NA
B.7.8g的Na2O2中含有的阴离子的数目为0.2NA
C.0.10 mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10 NA
D.54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA
难度: 困难查看答案及解析
-
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol H2O2完全分解转移的电子数为0.4 NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA
难度: 中等查看答案及解析
-
溴、碘主要存在于海水中,有“海洋元素”的美称.海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘.提取碘的途径如下所示:
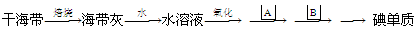
下列有关叙述正确的是
A.碘元素在海水中也有游离态存在
B.操作A是结晶或重结晶
C. B是提纯操作,常用蒸馏
D.在提取的过程中用的氧化剂可以是H2O2
难度: 中等查看答案及解析
-
短周期元素X的原子最外电子层中具有最多的未成对电子,元素Y的价电子排布式为nsnnpn+2,则X、Y组成的微粒中,不可能存在的是
A.X2Y5 B.XY42- C.XY2- D.XY3-
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法中正确的是
A.常温下,16gO2和O3的混合气体中含有l.5NA个氧原子
B.常温下,1Llmol·L-1Na2CO3溶液中所含的CO32-为NA
C.58g乙烯和乙烷的混合气体中碳原子数目一定为4NA
D.常温常压下,足量的Fe在lmolCl2中充分燃烧,转移的电子数为2NA
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏加德罗常数的值)
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.在常温常压下,1mol Ne含有的原子数为NA
C.22.4lCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同,而Ne由一个原子构成。相同状况下,相同体积的上述气体所含原子数就不相同。
难度: 中等查看答案及解析
-
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32―、SO32―、SO42―、C1―、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
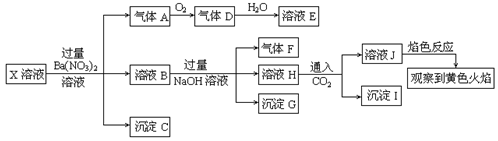
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42―
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+ 、Na+、K+和C1―
难度: 困难查看答案及解析
-
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0. 6 mol·L-1·s-1;③2 s时物质A的转化率为70%;④2 s时物质B的浓度为0.7 mol·L-1 其中正确的是
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
难度: 中等查看答案及解析
-
有A、B、C、D四种短周期元素在周期表中位置如图所示。
……
C
A
B
……
D
已知:A2+与C原子的电子数相差2。下列推断不正确的是
A.A和D组成的化合物是弱电解质且水溶液呈酸性
B.与A同周期且与C同主族的E元素,其最高价氧化物对应水化物在某些化学反应中常作催化剂。
C.离子半径:C>A>B
D.B与C形成的化合物是冶金工业的一种原料
难度: 中等查看答案及解析
-
在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
难度: 中等查看答案及解析
-
用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:① 加盐酸溶解;② 加过量苛性钠溶液;③ 过滤;④ 通入过量CO2;⑤ 加过量纯碱溶液,实验操作最合理的组合及顺序是
A.①⑤④③ B.②③④③ C.②③⑤③ D.①⑤③
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
B.将大理石投入到足量盐酸中:CO32-+2H+===CO2↑+H2O
C.将Cl2通入KI溶液中:2I-+Cl2===2Cl-+I2
D.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
难度: 中等查看答案及解析
-
有五瓶溶液分别是:①10mL 0.60moL·L-1NaOH溶液 ②20mL 10.50moL·L-1H2SO4溶液 ③30mL0.40moL·L-1HCl溶液 ④40mL0.30moL·L-1CH3COOH溶液 ⑤50mL0.20moL·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
A.⑤>④>③>②>① B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.①>②>③>④>⑤
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液2.0L,将它平均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗0.5mol H2SO4、2.0mol AgNO3。据此得知原混合溶液中的c(Na+)为
A.0.5 mol·L-1 B.0.75 mol·L-1
C.1.5 mol·L-1 D.1.0 mol·L-1
难度: 中等查看答案及解析
-
从下列实验事实所得出的相应结论不正确的是

难度: 中等查看答案及解析
-
在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
A
向FeCl2溶液中滴入氯水
2Fe2+ + Cl2 = 2Fe3+ + 2Cl—
向FeCl2溶液中滴入碘水
2Fe2+ + I2 = 2Fe3++2I—
B
CO2通入漂白粉溶液中
CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO
SO2通入漂白粉溶液中
SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO
C
向Na2CO3溶液中滴入稀HNO3
CO32— + 2H+ = CO2↑+ H2O
向Na2SO3溶液中滴入稀HNO3
SO32— +2H+ = SO2↑+H2O
D
向澄清石灰水中通入少量CO2 气体
Ca2++2OH— +CO2 = CaCO3↓+ H2O
向澄清石灰水中通入少量SO2 气体
Ca2++2OH— +SO2 = CaSO3↓+H2O
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
实验操作
现象
解释或结论
A
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
B
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体
HA放出的氢气多且反应速率快
HB酸性比HA强
C
在镁、铝为电极,氢氧化钠为电解质的原电池装置中
镁表面有气泡
金属活动性:Al>Mg
D
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热
未出现砖红色沉淀
Y中不含有醛基
难度: 中等查看答案及解析


