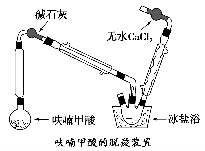
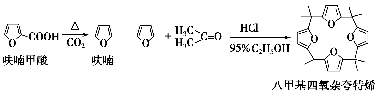-
V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
Y
V
X
W
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
难度: 中等查看答案及解析
-
化学与环境、材料、信息、能源关系密切,下列说法错误的是 ( )。
A.低碳生活注重节能减排,减少温室气体的排放
B.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
C.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
D.页岩气是从页岩层中开采出来的天然气,产气页岩分布广、厚度大,且普遍含气,故可以成为提供廉价而充足的新型燃料来源
难度: 中等查看答案及解析
-
下列有关化学用语正确的是( )。
A.核内有8个中子的碳原子:
B.CS2的结构式:S—C—S
C.乙烯的比例模型:
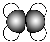
D.NH4Br的电子式:
难度: 中等查看答案及解析
-
下列各组离子中,在给定条件下能大量共存的是( )。
A.在pH=1的溶液中,NH4+,K+,ClO-,Cl-
B.有SO42-存在的溶液中:Na+,Mg2+,Ba2+,I-
C.有NO3-存在的强酸性溶液中:NH4+,Ba2+,Fe2+,Br-
D.在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+,S2-,AlO2-,SO32-
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不相对应的是( )。
A.SO2具有氧化性,可用于漂白纸浆
B.常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸
C.K2FeO4具有强氧化性,可用于自来水的杀菌消毒
D.Zn具有还原性和导电性,可用做锌锰干电池的负极材料
难度: 中等查看答案及解析
-
下列实验方案正确且能达到相应实验预期目的的是( )。
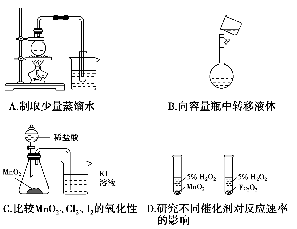
难度: 中等查看答案及解析
-
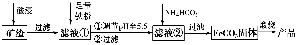
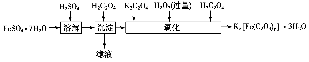
从海水中提取镁的工艺流程如图所示。
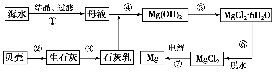
下列说法错误的是( )。
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑦电解MgCl2时阴极产生氯气
C.步骤⑥可将晶体置于HCl气氛中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
难度: 中等查看答案及解析
-
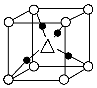
设NA为阿伏加德罗常数的值,下列叙述正确的是( )。
P4分子结构模型
A.常温常压下,16 g14CH4中所含的中子数为8NA
B.标准状况下,22.4 L CCl4中所含的分子数为NA
C.在1 L 1.0 mol·L-1 NaCl溶液中含有NA个NaCl分子
D.6.2 g白磷(分子式为P4,分子结构如图所示)中所含的P—P键数目为0.3NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )。
A.向AlCl3溶液中加入过量浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.将含有0.1 mol Ba(OH)2的溶液与含有0.2 mol NaHSO4的溶液混合:H++SO42-+OH-+Ba2+=BaSO4↓+H2O
C.向澄清石灰水中通入过量CO2:OH-+CO2=HCO3-
D.Na2O2溶于水:2O22-+2H2O=4OH-+O2↑
难度: 简单查看答案及解析
-
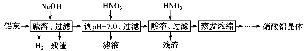
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )。
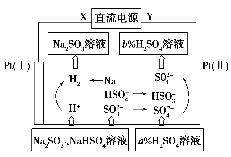
A.X为直流电源的负极,Y为直流电源的正极
B.图中的b>a
C.阳极区pH增大
D.该过程中的产品主要为H2SO4和H2
难度: 中等查看答案及解析
-
下列说法正确的是( )。
A.反应A(g)
2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-)
C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,
始终保持增大
难度: 中等查看答案及解析
-
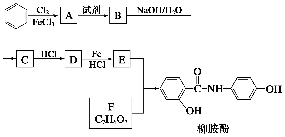
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
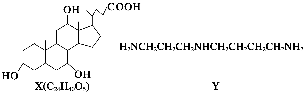
下列叙述错误的是( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
难度: 中等查看答案及解析
-
下列实验操作与预期目的或所得结论一致的是( )。
选项 实验操作 实验目的或结论
A 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 说明该钠盐是硫酸钠或硫酸氢钠
B 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 得到较纯净的乙酸乙酯
C 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 说明汽油中含有甲苯等苯的同系物
D 向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 除去FeCl2溶液中的FeBr2
难度: 中等查看答案及解析
-
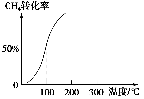
常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )。
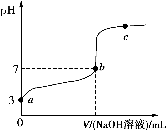
A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+)
D.a、b、c点表示的溶液中
均相等
难度: 中等查看答案及解析
-
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:2SO2(g)+O2(g)
2SO3(g)。达平衡时测得有关数据如下表。
容器
甲
乙
反应物投入量
2 mol SO2、1 mol O2
4 mol SO3
n(SO3)/mol
1.6
a
反应物的转化率
α1
α2
下列说法正确的是( )。
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率v(O2)=0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
难度: 中等查看答案及解析