-
下列说法不正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.对于ΔH>0的反应,反应物的能量小于生成物的能量
C.放热反应都不需要加热就能发生
D.吸热反应在一定条件(如常温、加热等)下也能发生
难度: 简单查看答案及解析
-
在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 简单查看答案及解析
-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+1/2O2(g)=CO(g) △H= -393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= +890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(g) △H= -2800 kJ/mol
难度: 中等查看答案及解析
-
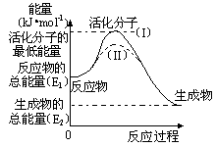
参照反应Br + H2
HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的

A.正反应为放热反应
B.正反应为吸热反应
C.加入催化剂,活化能改变引起反应热也改变
D.加入催化剂,正反应速率增大、逆反应速率减小
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / L·s B.υ(C)=0.5 mol / L·s
C.υ(B)=0.6 mol / L·s D.υ(A)=0.15 mol / L·s
难度: 简单查看答案及解析
-
一定条件下,在体积为1 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g),下列叙述能证明该反应已达到化学平衡状态的是
A.X的百分含量不再发生变化
B.c(X):c(Y):c(Z) =2:1:1
C.容器内气体的质量不再发生变化
D.同一时间内消耗2n mol X的同时生成n mol Z
难度: 中等查看答案及解析
-
现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol•L-1)
V/mL
c/(mol•L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是
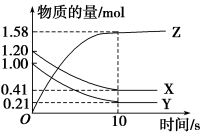
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,用Y表示的反应速率为0.0395mol·L-1·s-1
D.反应的化学方程式为X(g)+Y(g)=2Z(g)
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H= -57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
C.在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H= -285.8kJ/mol
D.由C(s,石墨)=C(s,金刚石) △H= +1.90kJ/mol可知,石墨比金刚石稳定
难度: 中等查看答案及解析
-
下列热化学方程式正确的是(注:△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g) △H= -1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq) == NaCl(aq) + H2O(l) △H= - 57.3kJ/mol(中和热)
C.S(s) + O2(g) == SO2(g) △H= -269.8kJ/mol(反应热)
D.2NO2==O2+2NO △H= +116.2kJ/mol(反应热)
难度: 简单查看答案及解析
-
反应C (s) + H2O (g)
CO (g) + H2 (g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2 使容器体积变大
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH= -226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为566 kJ/mol
B.图可表示由CO生成CO2的反应过程和能量关系

C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物质的量为为2 mol
难度: 中等查看答案及解析