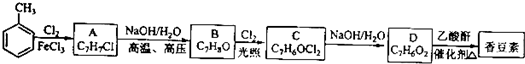
-
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
A.若PH>7时,则一定是c1V1=c2V2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2、c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是( )
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+难度: 中等查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S-F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.-1780kJ/mol
B.-1220 kJ/mol
C.-450 kJ/mol
D.+430 kJ/mol难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项 实验操作 实验现象 结论 A 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 均有固体析出 蛋白质均发生变性 B 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 出现白色沉淀 溶液X 中一定含有SO42- C 向一定浓度的Na2SiO3溶液中通入适量CO2气体 出现白色沉淀 H2SiO3 的酸性比H2CO3的酸性强 D 向浓度均为0.1mol•L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e-═LiFePO4 负极 Li-e-═Li+下列说法中正确的是( )
A.充电时电池反应为FePO4+Li═LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原难度: 中等查看答案及解析
-
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
A.改进汽车尾气净化技术,减少大气污染物的排放
B.开发利用可再生能源,减少化石燃料的使用
C.研发可降解高分子材料,减少“白色污染”
D.过度开采矿物资源,促进地方经济发展难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光易分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其他金属反应的产物中的Fe也显+3价难度: 中等查看答案及解析
-
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列正确的是( )
A.①④②③⑥⑤
B.④①②⑥⑤③
C.①④②⑥③⑤
D.④①②③⑥⑤难度: 中等查看答案及解析
-
某学生的实验报告中有下列数据:①用托盘天平称取11.7g氯化钠;②用100mL的量筒量取21.48mL盐酸;③用容量瓶配制216mL、1mol/L的氯化钠溶液;④用酸式滴定管量取25.00mL硫酸溶液;⑤用广泛pH试纸测定H2SO4溶液的pH为3.2.其中合理的是( )
A.只有①④
B.只有②④
C.只有①③
D.只有②⑤难度: 中等查看答案及解析
-
常温下0.1mol•L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol•L-1盐酸
D.提高溶液的温度难度: 中等查看答案及解析
-
将浓度为0.1mol•L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+)
B.Ka(HF)
C.
D.难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( )
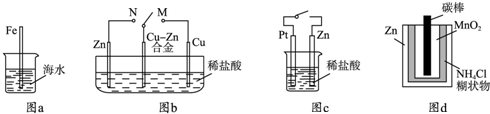
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的难度: 中等查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是( )
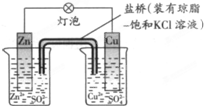
A.正极反应为:Zn-2e-=Zn2+
B.盐桥中的K+移向ZnSO4溶液
C.电池反应为:Zn+Cu2+=Zn2++Cu
D.在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极难度: 中等查看答案及解析
-
下列离子方程式表达正确的是( )
A.AlCl3溶液与过量氨水混合:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
B.用FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O⇌Fe(OH)3(胶体)+3H+
C.向Mg(HCO3)2中加足量的Ca(OH)2溶液:Ca2++2OH-+2HCO3-+2Mg2+=CaCO3↓+MgCO3↓+2H2O
D.用惰性电极电解熔融氯化钠:2Cl-+2H2OCl2↑+H2+2OH-
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
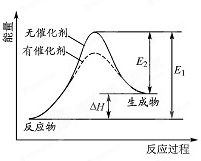
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变
C.沸水中滴加适量饱和FeC13溶液,形成带电的胶体,导电能力增强
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④>②>③难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用石墨做电极电解CuSO4溶液.通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的CuSO4和H2O
B.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu,Fe,Al
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电镀时,应将应将待镀的金属制品作阳极;粗铜的精炼,应将粗铜作阴极难度: 中等查看答案及解析
-
下列说法正确的是( )
A.一定温度下,反应MgCl2(1)=Mg(1)+Cl2(g)的△H>0△S>0
B.水解反应NH4++H2O⇌NH3•H2O+H+达到平衡后,升高温度平衡逆向移动,水解平衡常数Kh变小
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.纯水,水的离子积常数Kw 随着温度的升高而增大,pH也变大难度: 中等查看答案及解析
-
温度为T时,向4L恒容密闭容器中充入2.0molPCl5,反应PCl5(g)⇌PCl3(g)+Cl2(g),经一段时间后达到平衡.反应过程中测定的部分数据见下表.
下列说法正确的是( )t/s 50 150 250 350 n(PCl3)/mol 0.32 0.38 0.40 0.40
A.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0
B.反应在前50s的平均速率v(PCl3)=0.0032 mol•L-1•s-1
C.相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 molPCl3和0.40 molCl2,反应达平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入4.0 mol PCl3、和4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%难度: 中等查看答案及解析
-
25℃101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO4 2-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)△H=-57.3 kJ/mol
B.C8H18(l)+O2(g)=8CO2(g)+9H2O(g)△H=-5518 kJ/mol
C.KOH(aq)+H2SO4(aq)=
K2SO4(aq)+H2O(l)△H=-57.3 kJ/mol
D.2C8H18(g)+25O2(g)═16CO2(g)+18H2O(l)△H=-5518 kJ/mol难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
B.在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3)
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)难度: 中等查看答案及解析