-
请回答下列问题:
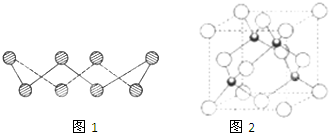
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是______.
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为______;O与F电负性大到小的顺序为______.(用<或=或>表示)
(3)34号元素的价层电子的电子排布图为______,在周期表位于______区;Mn2+基态的电子排布式为______.
(4)气态SO2分子的立体构型为______;SO32-离子的立体构型为______(均用文字描述)
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:______;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______.
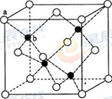
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是______.
-
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
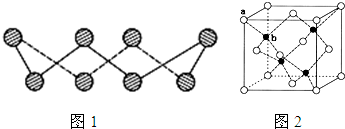
(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是________;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________;
(3)Se的原子序数为________,其核外M层电子的排布式为________;
(4)H2Se的酸性比 H2S________(填“强”或“弱”).气态SeO3分子的立体构型为________, 离子的立体构型为________;
离子的立体构型为________;
(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:________;
②H2SeO4比H2SeO3酸性强的原因:________.
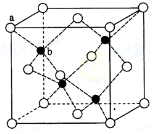
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为________g•cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)
-
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
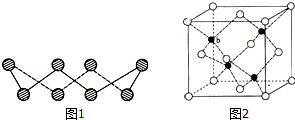
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”).气态SeO3分子的立体构型为 平面三角形,SO32﹣离子的立体构型为 三角锥形;
(5)H2SeO3的K1和K2分别为2.7×10﹣3和2.5×10﹣8,H2SeO4第一步几乎完全电离,K2为1.2×10﹣2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: ;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO4比H2SeO3酸性强的原因: ;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为 (列式并计算),a位置S2﹣离子与b位置Zn2+离子之间的距离为 pm(列式表示).
-
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
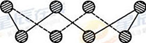
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为______;
(3)Se原子序数为______,其核外M层电子的排布式为______;
(4)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______平面三角形,SO32-离子的立体构型为______三角锥形;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:________;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
-
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是________;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为________;
(3)As原子序数为________,其核外M层和N层电子的排布式为________;
(4)NH3的沸点比PH3________(填“高”或“低”),原因是________.PO43-离子的立体构型为________;
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13.硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因________;
②硝酸比亚硝酸酸性强的原因________;
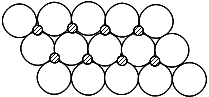
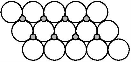
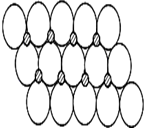
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为________cm(用含有a的代数式表示).在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为________g (氧离子的半径为1.40×10-10m)
-
ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)白磷单质中的P原子采用的轨道杂化方式是 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为 。
(3)As原子序数为 ,其核外M层和N层电子的排布式为 。
(4)NH3的沸点比PH3 (填“高”或“低”),原因是 。
P 的立体构型为 。
的立体构型为 。
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因 ;
②硝酸比亚硝酸酸性强的原因 。
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 cm(用含有a的代数式表示)。在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如下页图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为 g(氧离子的半径为1.40×10-10 m)。
-
【化学--选修3:物质结构与性质】
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是______;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______;
(3)As原子序数为______,其核外M层和N层电子的排布式为______;
(4)NH3的沸点比PH3______(填“高”或“低”),原因是______.
PO43-离子的立体构型为______;
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13.硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因______;
②硝酸比亚硝酸酸性强的原因______;
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为______
-
【选修3物质结构与性质】(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型
为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为 pm(列示表示)
-
IVA 族元素及其化合物在材料等方面有重要用途。回答下列问题:
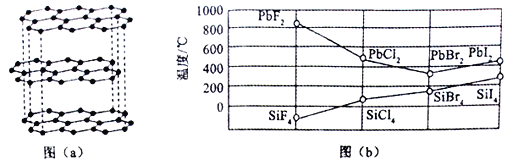
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为________________,依据电子云的重叠方式,原子间存在的共价键类型有_____________,碳原子的杂化轨道类型为_________。
(2)石墨烯是从石墨材料中剥离出来的、由单层碳原子组成的二维晶体。将氢气加入到石墨烯中可制得一种新材料石墨烷。下列判断错误的是___________。
A.石墨烯是一种强度很高的材料
B.石墨烯是电的良导体而石墨烷则为绝缘体
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与H2 制得石墨烷的反应属于加成反应
(3)四卤化硅SiX4的沸点和二卤化铅PbX2 的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I 次序升高的原因是_________________________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断: 依F、Cl、Br、I 次序,PbX2 中的化学键的离子性___________、共价性______________。(填 “增 强”“不变”或“减 弱 ”)
(4)碳的另一种单质C60,晶胞结构与金属铜晶胞相似,其晶胞参数为a nm,晶体密度为_______g·cm-3(只列计算式,不需化简)。
-
氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
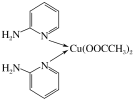
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。
(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:
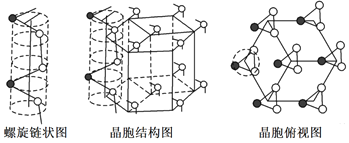
已知正六棱柱的边长为a cm,高为b cm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。













