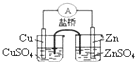
-
选修《物质结构》
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:______.
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是______.
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为______.
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为______其中心离子是______,配位数为______.
(5)根据下列五种元素的第一至第四电离能数据,回答下面各题:
①在周期表中,最可能处于同一族的是______和______.元素代号 I1 I2 I3 I4 Q 2080 4000 6100 9400 R 500 4600 6900 9500 S 740 1500 7700 10500 T 580 1800 2700 11600 U 420 3100 4400 5900
②T元素最可能是______区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为______,其中心原子的杂化方式为______.难度: 中等查看答案及解析
-
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素,D的最外层电子数是其内层电子数的三倍.已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的简单离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应.依据上述信息用化学用语回答下列问题:
(1)写出A与C形成化合物的电子式______.
(2)Cm-、E(m-1)-的还原性强弱为______>______,能证明其还原性强弱的离子方程式为______.
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式______.
(4)元素B形成的单质与Fe3O4反应的化学方程式是______ 4Al2O3+9Fe难度: 中等查看答案及解析
-
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:
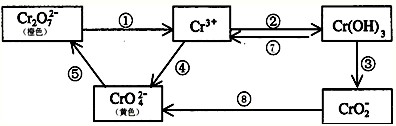
回答下列问题:
(1)上述转化关系中属于氧化还原反应的是______(填编号),其中需要使用氧化剂的是______(填编号).
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______.
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:______.
(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极______ 阴极______溶液中______.
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______.难度: 中等查看答案及解析
-
某同学设计下图装置进行铁和浓H2SO4反应的实验探究,请回答下列问题.
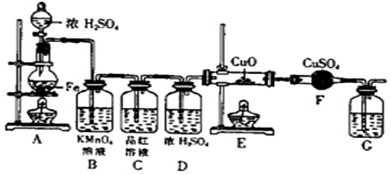
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是______.随后点燃A处酒精灯,就有气体产生了.
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:______,C中品红溶液颜色始终没有变化.
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是______.
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象______.
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是______
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是______,其物质的量为______mol,
气体2是______,其物质的量为______mol.难度: 中等查看答案及解析
-
[有机化学基础]
已知: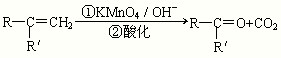 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):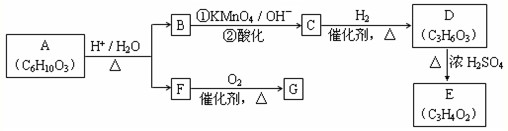
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基.已知1mol F与足量金属钠作用产生H2 22.4L(标准状况),则F的分子式是______,名称是______.
(2)G与F的相对分子质量之差为4,则G具有的性质是______(填字母).
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G最多可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______难度: 中等查看答案及解析