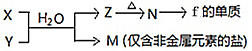-
下列有关物质性质的比较,错误的是
A.溶解度:小苏打 < 苏打 B.密度:溴乙烷 > 水
C.硬度:晶体硅 < 金刚石 D.碳碳键键长:乙烯 > 苯
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C.过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
难度: 困难查看答案及解析
-
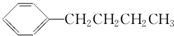 的同分异构体中,含有苯环且苯环上的一氯取代物只有一种的结构共有(不考虑立体异构)
的同分异构体中,含有苯环且苯环上的一氯取代物只有一种的结构共有(不考虑立体异构)A.2种 B.3种 C.4种 D.5种
难度: 困难查看答案及解析
-
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
A.K+、Cl-、NO3-、S2- B.Na+、Ca2+、Cl-、HCO3-
C.K+、Ba2+、Cl-、NO3- D. SO42-、Mg2+、I-、S2O32-
难度: 中等查看答案及解析
-
已知0.1 mol•L-1的醋酸溶液中存在电离平衡CH3COOH
CH3COO-+H+,要使溶液中c(CH3COOH)/ c(H+) 值减小,可以采取的措施是
A.加水 B.加少量冰醋酸 C.降低温度 D.加少量烧碱溶液
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
25 ℃时,等体积等浓度的NaHCO3和Na2CO3溶液中,下列判断错误的是
A.均存在电离平衡
B.阴离子数目前者大于后者
C.c(OH-)前者小于后者
D.存在的粒子种类相同
难度: 中等查看答案及解析
-
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是
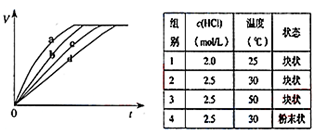
A.4-3-1-2 B.3-4-2-1 C.1-2-3-4 D.1-2-4-3
难度: 简单查看答案及解析
-
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是
A.5ν(NH3)=4ν(O2) B.5ν(O2)=6ν(H2O)
C.2ν(NH3)=3ν(H2O) D.5ν(O2)=4ν(NO)
难度: 简单查看答案及解析
-
下列关于化学反应的自发性叙述中正确的是
A.△H>0、∆S>0的反应肯定是自发的
B.△H>0、∆S<0的反应肯定是自发的
C.△H<0、∆S>0的反应肯定是自发的
D.△H<0、∆S<0的反应高温时是自发的
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D
将SO2通入酸性KMnO4溶液中
溶液的紫色褪去
SO2具有还原性
难度: 困难查看答案及解析
-
在25℃时将pH=11的NaOH溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.c (Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c (Na+) > c (CH3COO-)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
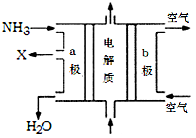
下列有关电化学装置的说法正确的是

A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
难度: 简单查看答案及解析
-
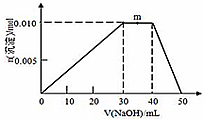
浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随
的变化如图所示,下列叙述错误的是
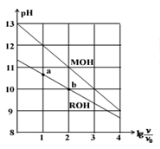
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当
=2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大
难度: 简单查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O
Al2O3+3H2↑,在电解过程中,以下判断正确的是

难度: 中等查看答案及解析