-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol过氧化钠中阴离子所带的负电荷数为NA
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA
C.28 g C16O与28 g C18O中含有的质子数均为14 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.醋酸钠的水解反应:CH3COO一+H3O+=CH3COOH+H2O
B.铜加入稀硝酸中: 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
D.澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
B.蔗糖、麦芽糖的分子式都是C12H22O1l,二者都属于低聚糖
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
D.等质量的丙醇和乙酸完全燃烧时所需氧气的质量相同
难度: 中等查看答案及解析
-
关于下列各实验装置的叙述中,正确的是( )
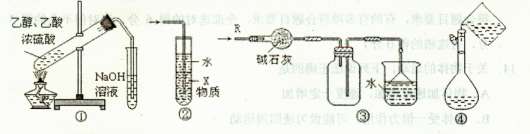
A.装置①制备乙酸乙酯
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥、收集Cl2,并吸收多余的Cl2
D.装置④配制一定物质的量浓度的溶液时转移液体
难度: 中等查看答案及解析
-
短周期主族元素A、B、C的原子序数依次递增,它们的族序数之和为11,A、C同主族,B原子最外层电子数比A原子次外层电子数多l。下列叙述正确的是( )
A.原子半径:B>C>A
B.A、C两元素的最高价氧化物对应水化物的酸性A弱于C
C.B的最高价氧化物的水化物只能与酸反应,不能与碱反应
D.B的最高价氧化物的熔点比A的最高价氧化物的熔点低
难度: 中等查看答案及解析
-
碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),下列说法不正确的是( )
A.该电池Zn为负极,MnO2为正极,电解质是KOH
B.放电时外电路电流由Zn流向MnO2
C.电池工作时OH-向锌电极移动
D.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH—
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH一)c(H+)
B.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
C.0.1 mol·L HA(一元酸)溶液与0.1 mol·L-1的NaOH溶液等体积混合:
c(H+)+c(Na+) c(OH一)+c(A-)
D.常温下0.4mol/L HA溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子C浓度的大小顺序为:c(A一)>c(H+)>c(Na+)>c(OH一)
难度: 中等查看答案及解析
-
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
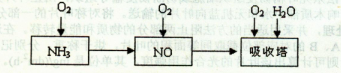
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式________。当温度升高时,化学平衡常数K值________(填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H=________。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8 mol,则反应速率v(N2)=________,平衡常数=________(保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡________(填向左、向右或不移动)移动。
难度: 中等查看答案及解析
-
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。
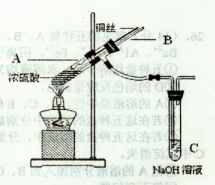
①装置A中发生反应的化学方程式为________;
②上图装置中导管B的作用你认为可能是(写出一种)________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过________、________、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致________。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式________。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是________(已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
难度: 中等查看答案及解析
-
【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
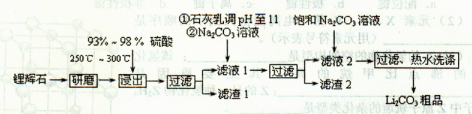
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)
Li2SO4+Al2O3·H2O↓
②某些物质的溶解度(S)如下表所示。
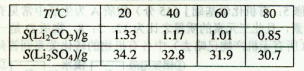
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
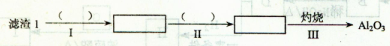
则步骤I中反应的离子方程式是________,步骤Ⅱ应通入一种气体试剂为________,步骤II反应完之后需要的操作是________。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示)________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是________。
②b中,生成Li2CO3反应的化学方程式是________。
难度: 中等查看答案及解析
-
【化学——选修3:物质结构与性质】(15分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:
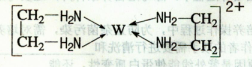
回答下列问题:
(1)W原子的核外电子排布式为________,该配离子中含有的化学键类型有________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是________(用元素符号表示)。
(3)Z的氢化物的空间构型是________;该氢化物的沸点比甲烷的高,其主要原因是________;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是________。
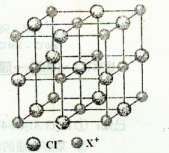
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是________;每个X+周围与其紧邻的Cl-围成的几何图形为________。
难度: 中等查看答案及解析
-
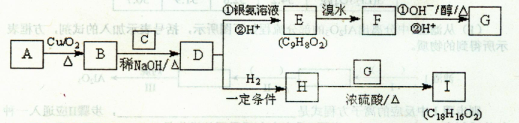
[化学——选修5:有机化学基础](15分)物质A为生活中常见有机物,只含有C、H、O三种元素,且此三元素的质量之比为12:3:8,物质D是一种芳香族化合物,请根据下图(所有无机产物已略去)中各有机物的转化关系回答问题:
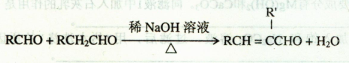
已知两分子醛在一定条件下可以发生如下反应(其中R、R′为H或烃基):
(1)写出物质A的结构简式:________;C的名称:________。
(2)F→G的有机反应类型为:________。
(3)写出H与G反应生成I的化学方程式:
。
(4)E有多种同分异构体,与E具有相同官能团的芳香族同分异构体有________种(包括本身和顺反异构),其中核磁共振氢谱有五个峰的同分异构体的结构简式有2种,任写出其中一种________。
(5)若F与NaOH溶液发生反应,则l mol F最多消耗NaOH的物质的量为________mol。
难度: 中等查看答案及解析