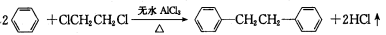-
以下食品化学知识的叙述不正确的是( )
A.食盐可作调味剂,也可作食品防腐剂
B.新鲜蔬菜做熟后,所含维生素C会有损失
C.浓硫酸可刻蚀石英制艺术品
D.“地沟油”禁止食用,但可以用来制肥皂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.在10g质量分数为46%的乙醇水溶液中含有H原子数目为1.2NA
B.标准状况下22.4LNO与11.2LO2混合后气体的分子数为2NA
C.4.0gH2与足量O2完全反应生成水,反应中断裂共价键数目为2NA
D.常温常压下,将0.1molFe投入足量浓硝酸中,转移电子数为0.3NA
难度: 简单查看答案及解析
-
分子式为C5H9ClO2的同分异构体甚多,其中能与NaHCO3发生反应产生CO2的同分异构体共有(不考虑立体异构)( )
A.4种 B.8种 C.12种 D.16种
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.等物质的量的NaX和弱酸HX混合后的溶液中
可能大于
B.在pH=4.5的
溶液中,
大于
C.向0.1 mol/L醋酸溶液中加入稀释的过程中
不断增大
D.0.1 mol·L—1 某一元酸HA溶液中
,则该溶液中由水电离出的
难度: 简单查看答案及解析
-
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的
实验方案
所选玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明HClO和CH3COOH的酸性强弱
同温下用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
玻璃棒、玻璃片
C
检验蔗糖水解产物具有还原性
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
试管、烧杯、酒精灯、滴管
D
配制1 L 1.6%的CuSO4溶液(溶液密度近似为1g/mL)
将25g CuSO4·5H2O溶解在975水中
烧杯、量筒、玻璃棒
难度: 简单查看答案及解析
-
a、b、c、d四种元素在周期表中的位置如下图,则下列说法正确的是

A. 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3
B. 若b的单质可作半导体材料,则c的单质不可能为半导体材料
C. 若b的单质与H2易化合,则c的单质与H2更易化合
D. a与b之间容易形成离子化合物
难度: 简单查看答案及解析
-
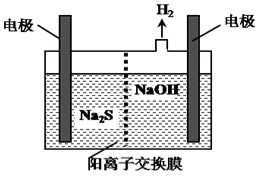
光电池是发展性能源。一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl (s)
Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl- (aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是

A.光照时,电流由X流向Y
B.光照时,Pt电极发生的反应为:2Cl-+2e-=Cl2↑
C.光照时,Cl-向Pt电极移动
D.光照时,电池总反应为:AgCl (s) +Cu+ (aq)
Ag (s) +Cu2+ (aq)+Cl-(aq)
难度: 简单查看答案及解析
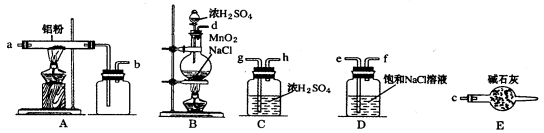
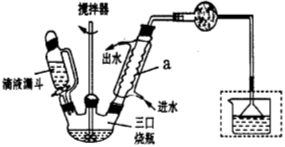
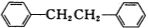 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: