-
空气和CO2按体积比5∶1混合,将混合气体与足量的红热焦炭充分反应,设空气中N2和O2的体积比为4∶1,不计其他成分,且体积均在同温、同压下设定,则反应后的气体中CO的体积分数是
A. 50% B. 29% C. 43% D. 100%
难度: 困难查看答案及解析
-
有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bmL1mol/L的盐酸中,使其充分作用后,残酸用25.25mLcmol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g)
A. 只含有a B. 只含有 b C. 必含有b D. 一定有a、b和c
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 18 g D2O和18 g H2O中含有的质子数均为10NA
B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 困难查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成
淀粉没有水解成葡萄糖
C
向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去
使溶液褪色的气体一定是乙烯
D
向水玻璃溶液中通入足量CO2 后,产生白色浑浊
生成了硅酸沉淀
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 molN2与4mol H2反应生成的NH3分子数为2NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
难度: 困难查看答案及解析
-
在100克浓度为18mol/L.密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加水的体积为(提示:硫酸溶液越浓,其密度越大)
A. 小于100mL B. 等于100mL
C. 大于100mL D. 无法确定
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是( )
A. 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
B. 2L 0.5 mol/L的氯化镁溶液中所含的粒子数为3NA
C. NA个SO2分子所占的体积与 NA个SO3分子所占的体积比1:1
D. 标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 27g铝加入lmol/L的NaOH溶液,转移电子数是3NA
B. 28gN2与CO混合物中原子总数是4NA
C. 一定条件下,将1g乙炔(C2H2)溶于12g苯,所得混合物中含有的碳原子数为NA
D. 标准状况下,2.24 L C10H22分子中共价键总数为31 NA
难度: 困难查看答案及解析
-
同温同压下,体积相同的两个容器中,分别充满由14N、13C、18O三种原子构成的一氧化氮(14N18O)和一氧化碳(13C18O)。下列说法正确的是( )
A. 所含分子数和质量均不相同
B. 含有相同的质子和中子
C. 含有相同的分子数和电子数
D. 含有相同数目的中子、原子和分子
难度: 困难查看答案及解析
-
在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是()
A. 0.5molNa和0.5molMg B. 0.1molZn和0.1molAl
C. 8.4gMgCO3和8.4gNaHCO3 D. 10gCaCO3和10gMgCO3
难度: 困难查看答案及解析
-
在一定条件下,8.8gCO2与足量的Na2O2固体完全反应后,产生的气体全部收集起来只有1.68L(标准状况),则此气体在标准状况下的密度为()
A. 1.43g/L B. 1.90g/L C. 2.14g/L D. 2.38g/L
难度: 困难查看答案及解析
-
将一块铁片放入500mL,
的
溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中
的物质的量浓度是()
A. 0.9mol/L B. 0.85mol/L C. 0.8mol/L D. 0.75mol/L
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,56 g乙烯和丙烯的混合气中含有的碳原子数为4NA
B. 1.2 g NaHSO4晶体中含有的阳离子和阴离子的总数为0.03NA
C. 12 g金刚石中含有的共价键数为4NA
D. 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
难度: 困难查看答案及解析
-
已知等体积的20%硫酸溶液其质量大于10%硫酸溶液,则将溶质的质量分数为a%、物质的量浓度为C1 mol·L-1的稀硫酸加热蒸发掉溶液总质量的一半的水,此时溶质的质量分数变为b%,物质的量浓度为C2 mol·L-1,下列关系正确的是
A. b﹤2 a B. C2﹤2 C1 C. C2﹥2 C1 D. C1=2C2
难度: 困难查看答案及解析
-
含铁废液中铁元素的回收是工业生产的孟重要研究课题,一般将铁元素先转化为沉淀,再从废液中分离出来。转化为黄铁矾沉淀是其中的一种方法。流程如下:
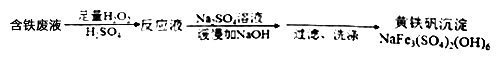
下列说法正确的是
A. 加H2O2的目的是将Fe2+还原成Fe3+,因此也可以用氯水代替H2O2
B. 洗涤沉淀时,为洗涤充分,向漏斗中加水没过沉淀物后需要用玻璃棒搅拌
C. pH越高越有利于黄铁矾沉淀的生成,因此应加过量的NaOH
D. 生成黄铁矾沉淀的反应方程可表示为:3Fe2(SO4)3+12NaOH=2NaFe3(SO4)2(OH)6↓+5Na2SO4
难度: 困难查看答案及解析
-
下列实验装置能达到实验目的是( )

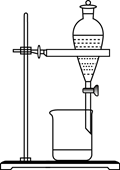
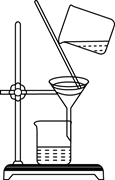
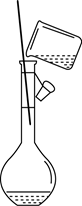
A.用海水制蒸馏水
B.将碘水中的碘单质与水分离
C.除去Fe(OH)3胶体中的FeCl3
D.稀释浓硫酸
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列实验现象预测正确的是

A. 实验I:振荡后静置,上层溶液颜色保持不变
B. 实验II:试管溶液中中出现气泡,溶液先出现浑浊后变澄清
C. 实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验IV:加热至混合液呈红褐色,停止加热,该分散系产生丁达尔效应
难度: 困难查看答案及解析
-
海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是( )
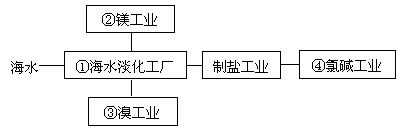
A. ①中可采用蒸馏法
B. ②制镁过程中用到的沉淀剂是石灰乳
C. ③中提溴涉及到复分解反应
D. ④的产品可生产盐酸、漂白液等
难度: 困难查看答案及解析
-
为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH==
=2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A. 1 mol甲苯含有6NA个C—H键
B. 18 g H2O含有10NA个质子
C. 标准状况下,22.4 L氨水含有NA个NH3分子
D. 56 g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 困难查看答案及解析