-
短周期元素X、Y组成的化合物X2Y,那么X、Y所在主族序数可能是( )
A. ⅡA和ⅦA B. ⅤA和ⅥA C. ⅥA和ⅥA D. ⅠA和ⅥA
难度: 简单查看答案及解析
-
下列各组粒子中属于同位素的是( )
A. 16O和18O B. H2O和D2O C. H2和D2 D. 24Mg和24Na
难度: 简单查看答案及解析
-
已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
A. 原子序数:Y>X>Z>W
B. 离子半径:X>Y>Z>W
C. 原子最外层电子数:Z>W>Y>X
D. 还原性:X>Y,W2—>Z—
难度: 中等查看答案及解析
-
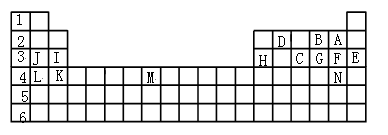
右图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,下说法中不正确的是( )
A. 原子半径大小顺序是c>b>d>a
B. d的氢化物比a的氢化物稳定
C. a和d的原子结合可以形成带3个负电荷的阴离子
D. a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a
难度: 中等查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A. 元素非金属性按X、Y、Z的顺序增强
B. 简单阴离子的还原性按X、Y、Z的顺序减弱
C. 气态氢化物的稳定性按X、Y、Z的顺序增强
D. 单质的氧化性按X、Y、Z的顺序减弱
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.离子化合物中只能含有离子键
B.共价化合物中可能含有离子键
C.化学键存在于分子之间
D.化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程
难度: 中等查看答案及解析
-
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A. Z2Y B. X2Y2 C. Z2Y2 D. ZYX
难度: 中等查看答案及解析
-
已知钡的金属活动性介于钠和钾之间,下列叙述中正确的是( )
A. 钡与水反应不如钠与水反应剧烈 B. 钡可以从NaCl溶液中置换出钠
C. 氧化性:K+>Ba2+>Na+ D. 碱性:KOH>Ba(OH)2>NaOH
难度: 简单查看答案及解析
-
下列有关化学用语书写正确的是( )
A. CO2的电子式
B. Cl- 的结构示意图:
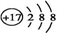
C. HBr分子的电子式:
D.
粒子的结构示意图:
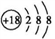
难度: 简单查看答案及解析
-
下列说法正确的是
A.若反应X+Y===M是放热反应,该反应一定不用加热
B.需要加热方能发生的反应一定是吸热反应
C.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
D.1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的能量称为中和热
难度: 中等查看答案及解析
-
已知某原电池中某一极的电极反应式为Cu-2e-=Cu2+,则另一极的电极反应式可能是( )
A. H2-2e-=2H+ B. 2H++2e-=H2
C. Fe2++2e-=Fe D. 2Ag++2e-=2Ag
难度: 中等查看答案及解析
-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 困难查看答案及解析