-
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂。下列物质不属于食品抗氧化剂的是
A.糕点中的配料维生素C
B.方便面里的味精(谷氨酸钠)
C.葡萄酒中的少量二氧化硫
D.火腿肠中的少量亚硝酸钠
难度: 简单查看答案及解析
-
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药——青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖。青蒿素的结构如图所示,下列关于青蒿素的说法错误的是
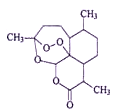
A.分子中含有3种官能团
B.易溶于苯,难溶于水
C.可与NaOH溶液发生水解反应
D.其同分异构体不可能有芳香族化合物
难度: 中等查看答案及解析
-
已知,H2和I2反应的历程为:①I2+M
2I·+M慢 ②H2+2I·→2HI快,式中M是指反应器壁或其他惰性分子,不参与反应,只具有传递能量的作用。下列关于该反应的说法正确的是
A.反应速率与I·的浓度有关
B.M是该反应的催化剂
C.反应①与②的活化能相等
D. v(H2)=v(I2)=v(HI)
难度: 中等查看答案及解析
-
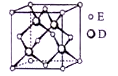
七种短周期元素在元素周期表中的相对位置如表所示。其中B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,下列说法正确的是
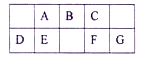
A.氧化物对应的水化物的酸性:G一定强于F
B.简单离子的半径:F>G>C>D
C.1 mol EC2中含2 mol E-C键
D.A、G分别与氢元素形成的化合物中,化学键均为极性共价键
难度: 中等查看答案及解析
-
No为阿伏加德罗常数的值。下列叙述正确的是
A.1 mol氢氧根离子与1 mol羟基所含电子数均为l0No
B.2.8gN2和CO的混合物中,所含分子总数为0.2No
C.标准状况下,11.2 L甲醛气体所含σ键数目为1.No
D.2.24 L C02与足量的Na202反应,转移的电子总数必为0.1No
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.将Fe(OH)3加入氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
B.将H2S气体通入到CuSO4溶液中:S2-+Cu2+=CuS↓
C.向含l mol FeBr2的溶液中通入l mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.向Al2(S04)3溶液中加入过量Ba(OH)2溶液,有白色沉淀生成2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 中等查看答案及解析
-
下列除去杂质所选试剂和方法均正确的是
A.除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯
B.除去Fe(OH)3胶体中的NaCl:用水溶解后过滤
C.除去苯中的苯酚:加入浓溴水后过滤
D.除去溴乙烷中的溴:加入Na2S03溶液再分液
难度: 中等查看答案及解析