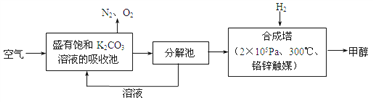
-
对于合成氨反应(放热),达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.4.2g聚乙烯中含有的碳原子数目为0.3NA
B.25℃时,pH=1的H2SO4溶液中含有的H+数目为0.1NA
C.7.8gNa2O2与足量的水反应,转移的电子总数为0.2NA
D.在有浓硫酸并加热的条件下,1mol乙酸和1mol乙醇充分反应最后生成NA个乙酸乙酯分子
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 溶解度大的化合物一定是强电解质
B. 胶体与溶液的本质区别是分散剂粒子大小的不同
C. 物质在发生化学反应的过程中,都伴随着能量的变化
D. 金属的冶炼必须在高温下进行
难度: 简单查看答案及解析
-
10mL浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成体积的是
A. 浓硫酸 B. CuSO4 C. CH3COONa D. Na2CO3
难度: 中等查看答案及解析
-
在与Al反应能放出H2的无色溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42- ③Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
难度: 简单查看答案及解析
-
在可逆反应2A(g)+3B(g)
xC(g)+D(g)中,已知:反应开始加的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均速率为0.5 mol·L-1·min-1。2 min末,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是
A. x=1
B. 2 min末时A和B的浓度之比为5∶3
C. 2 min末时B的浓度为1.5 mol·L-1
D. 前2 min,A的消耗浓度为0.5 mol·L-1
难度: 中等查看答案及解析
-
一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)
CH3OCH3(g)+H2O(g) 下列说法正确的是
编号
温度
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
Ⅰ
387℃
0.20
0.080
0.080
Ⅱ
387℃
0.40
Ⅲ
207℃
0.20
0.090
0.090
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
难度: 中等查看答案及解析
-
对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增大 ②生成物的产量一定增加 ③反应物的转化率一定增大④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了适宜的催化剂.
A. ②⑤ B. ①② C. ③⑤ D. ④⑥
难度: 中等查看答案及解析
-
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
2C(g) △H<0。t1 时刻达到平衡后,在t2 时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. 0~t2时间段内,υ正> υ逆
B. I、Ⅱ两过程达到平衡时,A的体积分数I﹥II
C. t2 时刻改变的条件可能是向密闭容器中加C
D. I、II两过程达到平衡时,平衡常数I﹤II
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,下列研究目的和示意图相符的是
A
B
C
D
研究
目的压强对反应的影响(P2>P1)
温度对反应的影响
平衡体系增加N2对反应的影响
催化剂对反应的影响
图示




难度: 中等查看答案及解析
-
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
A.16.7% B.20.0% C.80.0% D.83.3%
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向小苏打溶液中加入足量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B. 向醋酸钠溶液中通入少量的二氧化碳:2CH3COO- + CO2 + H2O=2CH3COOH+CO
C. 向溴化亚铁溶液通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D. 向氢氧化钡溶液中加入硫酸氢钠溶液至恰好完全沉淀:Ba2+ +OH-+H++SO42- =BaSO4↓+H2O
难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是
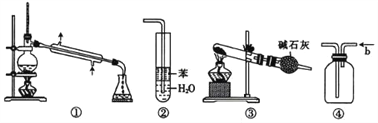
A. 装置①常用于分离互不相溶液体混合物
B. 装置②可用于吸收HCl气体,并防止倒吸
C. 以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D. 装置④b口进气排空气法可收集CO2、NO等气体
难度: 中等查看答案及解析
-
将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为
A. 0.02g B. 0.46g C. 0.80g D. 0.23g
难度: 困难查看答案及解析
-
“便携式乙醇测量仪”运用燃料电池的工作原理。在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A. 另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
B. 电池内部H+向负极移动
C. 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
D. 乙醇在正极发生反应,电子经过外电路流向负极
难度: 中等查看答案及解析
-
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是
A. NO B. NO2 C. N2O D. NH4NO3
难度: 困难查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
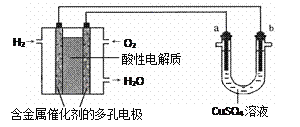
A. 燃料电池工作时,通入氢气的是正极
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 中等查看答案及解析
-
今有室温下四种溶液,有关叙述不正确的是
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
难度: 中等查看答案及解析
-
下列事实中不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的pH=2.1
⑤CH3COONa和H3PO4反应,生成CH3COOH
⑥0.1 mol·L-1的CH3COOH溶液稀释100倍,pH<3
A. ② B. ②⑤ C. ①③⑤ D. ③④⑤⑥
难度: 困难查看答案及解析
-
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
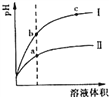
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
难度: 困难查看答案及解析