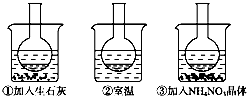
-
若溶液中由水电离产生的c(OH-)=1×10-14mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl-
B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2-
D.K+、NH4+、SO42-、NO3-难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.电能是二次能源
B.水力是二次能源
C.天然气是二次能源
D.水煤气是一次能源难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,而且△H>0的是( )
A.灼热的碳与CO2反应
B.Ba(OH)2•8H2O与NH4Cl的反应
C.铝片与稀H2SO4反应
D.甲烷在O2中的燃烧反应难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液
B.由强酸、强碱等物质的量反应制得的溶液
C.c(H+)=c(OH-)的溶液
D.非电解质溶于水得到的溶液难度: 中等查看答案及解析
-
用蒸馏水逐步稀释0.2mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-)
B.c(NH4+)
C.c
D.c(NH4+)/c难度: 中等查看答案及解析
-
在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
A.υ(A)=0.5 mol/
B.υ(B)=1 mol/
C.υ(C)=0.8 mol/
D.υ(D)=0.3 mol/难度: 中等查看答案及解析
-
中和相同体积相同pH值的Ba(OH)2,NaOH和NH3•H20三种稀溶液所用相同浓度盐酸的体积分别是V1,V2,V3,它们的关系是( )
A.V3>V2>V1
B.V3>V2=V1
C.V3=V2>V1
D.V1=V2>V3难度: 中等查看答案及解析
-
下列物质的强电解质/弱电解质/非电解质分类组合全部正确的是( )
A.NaCl/HF/Cl2
B.Ba(OH)2/H2S/蔗糖
C.AgCl/HClO/Cu
D.H2SO4/BaCO3/CO2难度: 中等查看答案及解析
-
下列关于电解质的说法正确的是( )
A.强电解质溶液的导电性一定比弱电解质溶液的导电性强
B.强电解质在稀的水溶液中全部以离子的形态存在
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.水溶液中导电能力差的电解质一定是弱电解质难度: 中等查看答案及解析
-
下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
A.仅①④
B.仅②④
C.仅①②
D.全部难度: 中等查看答案及解析
-
在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志的是( )
①C的生成速率是B的生成速率的倍
②单位时间生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化
⑥单位时间消耗 a mol A,同时生成3a mol B
⑦A、B、C 的分子数目比为1:3:2.
A.②⑦
B.⑥④
C.①③
D.⑤⑥难度: 中等查看答案及解析
-
关于平衡常数,下列说法不正确的是( )
A.平衡常数不随反应物或生成物的浓度的改变而改变
B.平衡常数随温度的改变而改变
C.平衡常数随压强的改变而改变
D.使用催化剂不能使平衡常数增大难度: 中等查看答案及解析
-
下列电离方程式正确的是( )
A.NaHSO4═Na++HSO4-
B.NaHCO3⇌Na++H++CO23-
C.H3PO4⇌3H++PO43-
D.HF⇌H++F-难度: 中等查看答案及解析
-
25℃时,向纯水中加入NaOH,使溶液的pH为11,则该溶液中由NaOH电离出的c(OH-)与由水电离出的c(OH-)之比为( )
A.1010:1
B.5×109:1
C.108:1
D.1:1难度: 中等查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是 ( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡
②配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线
③中和滴定时,锥形瓶内有少量水
④酸式滴定管用蒸馏水洗后,未用标准液洗
⑤读取滴定管终点读数时,仰视刻度线.
A.①②③
B.②④⑤
C.③④⑤
D.①②③④⑤难度: 中等查看答案及解析
-
水的三态的熵值的大小关系正确的是( )
A.S(s)>S(l)>S(g)
B.S(l)>S(s)>S(g)
C.S(g)>S(l)>S(s)
D.S(g)>S(s)>S(l)难度: 中等查看答案及解析