-
下列关于化学反应速率说法中不正确的是
A.反应速率用于衡量化学反应进行的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D.增大反应物的浓度、提高反应温度都能增大反应速率
难度: 中等查看答案及解析
-
化学与生产生活、环境保护、资源利用密切相关。下列做法不正确的是
A.用工业废水直接灌溉农田 B.用可降解塑料做购物袋
C.将煤气化或液化获得清洁燃料 D.火力发电厂的燃煤中加适量石灰石
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.HCl的电子式:
B.氯离子的结构示意图:
C.甲烷分子的比例模型:
D.核内有8个中子的碳原子:
难度: 中等查看答案及解析
-
下列物质中含有离子键的是
A.Na B.CO2 C.SiO2 D.KCl
难度: 简单查看答案及解析
-
下列物质互为同分异构体的是
A.氧气和臭氧 B.正丁烷和异丁烷
C.甲烷和乙烯 D.1H和2H
难度: 中等查看答案及解析
-
全部由第三周期元素形成的化合物是
A.HF B.NO C.Na2S D.MgF2
难度: 简单查看答案及解析
-
下列离子在溶液中可以大量共存的一组是
A.Na+ NO3- SO42- B.Ag+ NO3- Cl-
C.K+ H+ HCO3- D.NH4+ Na+ OH-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,2.24 L H2O中分子的数目为0.1 NA
B.0.1 mol·L-1 NH4Cl溶液中含有Cl-的数目为0.1 NA
C.常温下,1.7 g NH3中含有氢原子数目为0.3 NA
D.5.6 g铁粉在足量的氯气中充分燃烧,转移电子数为0.2 NA
难度: 中等查看答案及解析
-
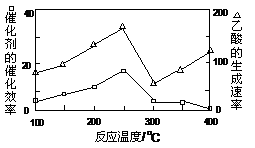
下列关于化学反应与能量的说法正确的是
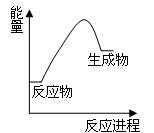
A.中和反应是放热反应 B.H2燃烧时的能量变化如图所示
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
难度: 中等查看答案及解析
-
下列有关物质用途的说法不正确的是
A.碳酸氢铵常用作氮肥 B.浓硫酸可用于干燥氨气
C.油脂可以制造肥皂 D.食醋可用于清除暖水瓶中的水垢
难度: 中等查看答案及解析
-
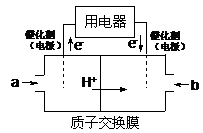
下图为某原电池的示意图,下列说法正确的是
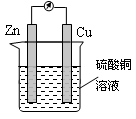
A.铜片作负极 B.溶液的颜色逐渐变浅
C.电子由铜棒流出 D.锌片上发生还原反应
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型和晶体类型均相同的是
A.NH3和NH4Cl B.HCl和SiO2
C.KCl和K D.CO2和H2O
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.苯中碳碳键是介于C-C和C=C之间的一种特殊共价键
B.甲烷、乙烯都能使酸性KMnO4溶液褪色
C.葡萄糖溶液中加入银氨溶液,水浴加热有银镜生成
D.医用酒精能使蛋白质变性,可用于消毒杀菌
难度: 中等查看答案及解析
-
下列有关元素周期表的说法正确的是
A.元素周期表有8个主族
B.0族原子的最外层电子数均为8
C.ⅠA族的元素全是金属元素
D.短周期是指第1、2、3周期
难度: 中等查看答案及解析
-
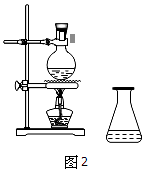
下列装置或操作能达到实验目的的是
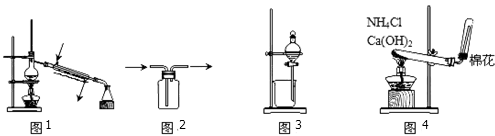
A.图1用于蒸馏石油
B.图2用于收集NO
C.图3用于分离乙酸和乙酸乙酯混合物
D.图4用于实验室制取NH3
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A.原子半径:W >Z >X
B.非金属性:Z>Y
C.最高化合价:Z >X
D.最高价氧化物对应水化物的酸性:W>Z
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑
B.NO2溶于水:3NO2+H2O= 2H++2NO3–+NO
C.氢氧化铜与稀硝酸反应:H++OH– = H2O
D.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O
难度: 中等查看答案及解析
-
一定温度下,将2 mol SO2 和1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+O2(g)
2SO3(g) △H = -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.反应放出197 kJ 的热量 B.生成SO3为2 mol
C.SO2和SO3 物质的量之和为2 mol D.SO2的物质的量和SO3 物质的量一定相等
难度: 中等查看答案及解析
-
下列关于乙醇和乙酸的说法正确的是
A.都是常用调味品的主要成分 B.都能使紫色石蕊溶液褪色
C.都能和CaCO3反应 D.都能发生酯化反应
难度: 中等查看答案及解析
-
现有一定量的Cu和CuO混合物,向其中加入0.6 L 2.0 mol/L稀硝酸,混合物完全溶解,同时生成4.48 L NO(标准状况)。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0 g固体。(忽略溶液的体积变化)。下列说法正确的是
A.该混合物中铜的质量为19.2 g
B.与该混合物反应消耗的HNO3的量为1.2 mol
C.加入NaOH溶液的体积是800 mL
D.Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L
难度: 极难查看答案及解析