-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4 L水与22.4 L氢气所含原子数均为2 NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A. 1:1 B. 2:3 C. 3:2 D. 1:6
难度: 简单查看答案及解析
-
将一小块金属钠长期露置于空气中发生一系列变化后,最终产物是
A. NaOH B. Na2O C. Na2O2 D. Na2CO3
难度: 简单查看答案及解析
-
铁和铁合金是生活中常见的材料,下列说法正确的是
A. 铁与盐酸反应,铁合金不与盐酸反应
B. 一定条件下,铁粉可与水蒸气反应
C. 不锈钢是铁合金,只含金属元素
D. 纯铁的硬度和强度均高于铁合金
难度: 中等查看答案及解析
-
下列物质中属于电解质的是
A.CO2 B.BaSO4 C.Zn D.食盐水
难度: 简单查看答案及解析
-
下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是
A. ①②⑥ B. ②③⑥ C. ③④⑥ D. ④⑤⑥
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应又是离子反应的是
A. 用CO还原氧化铁来炼铁 B. 用锌和稀盐酸反应制氢气
C. 用稀硫酸除铁锈 D. CO2通入澄清石灰水变浑浊
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 氯气溶于水形成的溶液能导电,故氯气是电解质
B. 没有氧元素参加的反应一定不是氧化还原反应
C. 在水中能电离出H+ 的化合物一定是酸
D. 有单质生成的分解反应一定是氧化还原反应
难度: 中等查看答案及解析
-
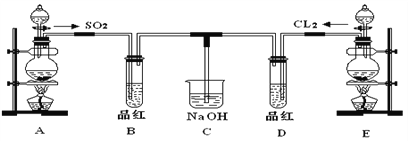
下列对SO2和SO3的叙述正确的是
A. 通常条件下,都是无色气体,都易溶于水
B. 都是酸性氧化物,其水溶液都是强酸
C. 都可使品红溶液褪色,加热时红色又能再现
D. 都能跟碱溶液反应
难度: 中等查看答案及解析
-
下列物质属于纯净物的是( )
A. 漂白粉 B. 盐酸 C. 氯水 D. 液氯
难度: 中等查看答案及解析
-
光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是
A. Na2CO3 B. CaO C. CaCO3 D. SiO2
难度: 中等查看答案及解析
-
一定量的浓硝酸与过量的铜充分反应,生成的气体是( )
A. 只有NO2 B. 只有NO C. NO2和NO D. NO2和H2
难度: 中等查看答案及解析
-
甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-或I-)离子,向甲中加入淀粉溶液和新制的氯水,溶液变为橙色,再加入丙溶液,颜色无明显变化,则甲、乙、丙依次为( )
A. Br-、Cl-、I- B. Br-、I-、Cl-
C. I-、Br-、Cl- D. Cl-、I-、Br-
难度: 困难查看答案及解析
-
下列各项递变规律错误的是:
A. 沸点:NH3<PH3<AsH3 B. 非金属性:N>P>As
C. 还原性:AsH3>PH3>NH3 D. 酸性:HNO3>H3PO4>H3AsO4
难度: 简单查看答案及解析
-
下列说法正确的是
A. SiO2是酸性氧化物,它不溶于水也不溶于任何酸
B. SiO2制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应
C. 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强
D. CO2通入水玻璃中可得硅酸
难度: 中等查看答案及解析
-
由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是
A. 锌 B. 铁 C. 铝 D. 镁
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A. 铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
B. NaHCO3溶液与NaOH溶液反应: OH― + HCO3― = CO32― + H2O
C. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
D. 氯化铝溶液中加入过量的氨水 : Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O
难度: 中等查看答案及解析
-
某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A. 一定存在HCl B. 一定存在SO2
C. 肯定没有CO2 D. 不能肯定是否含有HI
难度: 中等查看答案及解析
-
某溶液由相同物质的量的CuCl2、FeCl3、AlCl3混合而成,向该溶液中加入铁粉,充分搅拌后振荡,铁粉仍有剩余,则溶液中存在较多的阳离子是
A. Fe3+、Cu2+ B. Fe2+、Al3+
C. Fe3+、Al3+ D. Fe2+、Fe3+
难度: 简单查看答案及解析
-
除去镁粉中混有的少量铝粉, 可选用的试剂是
A. 盐酸 B. NaOH溶液 C. 硝酸 D. 食盐水
难度: 中等查看答案及解析
-
将Na2O2投入FeCl2溶液中,可观察到的实验现象是
A. 有白色沉淀生成 B. 有红棕色沉淀生成
C. 没有沉淀生成 D. 既有红棕色沉淀生成又有无色气体产生
难度: 中等查看答案及解析
-
在一定条件下, RO3n-与R2-发生如下反应:RO3n- +2 R2-+6H+=3R+3H2O,下列关于元素R的叙述中正确的是
A. R原子的最外层上有4个电子 B. RO3n-中的R只能被还原
C. HnRO3一定是强酸 D. R的单质既具有氧化性又具有还原性
难度: 中等查看答案及解析
-
1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用。铝在下列应用时应加以控制的是
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂
⑥用氢氧化铝凝胶剂加工成胃舒平药片 ⑦易拉罐 ⑧包装糖果和小食品
A. ③⑤⑦⑧ B. ⑥⑦⑧ C. ③⑤⑧ D. ③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
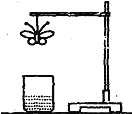
A
B
C
D
纸蝴蝶上的喷洒液
石蕊
酚酞
酚酞
石蕊
小烧坏中的溶液
浓盐酸
浓氨水
氢氧化钠溶液
浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
难度: 简单查看答案及解析
-
在氮的氧化物中,氮氧质量比为7∶12,则氮的化合价为
A. +2 B. +3 C. +4 D. +5
难度: 简单查看答案及解析
-
将盛有N2和NO2混合气体25mL的量筒倒立于水槽里,过一段时间后,气体体积缩小到15mL后不再变化(同温同压下),原混合气体中N2和NO2的体积比是
A. 4∶1 B. 2∶3 C. 1∶4 D. 2∶1
难度: 中等查看答案及解析
-
有关Na2CO3和NaHCO3的叙述中正确的是
A. 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B. Na2CO3比NaHCO3热稳定性强
C. Na2CO3和NaHCO3均不可与澄清石灰水反应
D. Na2CO3和NaHCO3均可与NaOH溶液反应
难度: 中等查看答案及解析