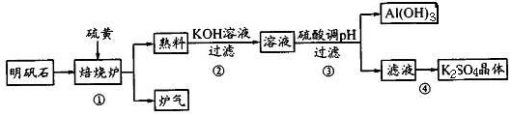
-
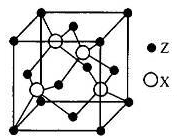
教材中下列图示物质对应的主要成分错误的是
A
B
C
D
物质




主要
成分
Fe2O3
S
硅酸盐
烃
难度: 简单查看答案及解析
-
下列化学用语表达正确的是
A.乙酸分子比例模型:

B.原于核内有18个中子的原子:
Cl
C.铬原于价电子层排布图:

D.过氧化氢电子式:
难度: 中等查看答案及解析
-
从分类角度,下列说法正确的是
A.水玻璃与硅胶均属于酸
B.漂白液与漂粉精的主要成分均为钠盐
C.NO2、SO3均属于酸性氧化物
D.醋酸、一水合氨均属于弱电解质
难度: 中等查看答案及解析
-
下列比较正确的是
A.电负性:As>S>P B.第一电离能F>N>O
C.熔点.BN> CCl4> MgBr2 D.溶解性:乙醛>苯酚>乙醇
难度: 中等查看答案及解析
-
金属M和N可构成如图所示的装置.下列分析正确的是
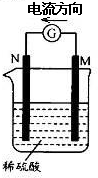
A.金属活泼性N>M
B.M逐渐溶解
C.负极反应为2H++2e- =H2↑
D.SO42-向M极定向移动
难度: 中等查看答案及解析
-
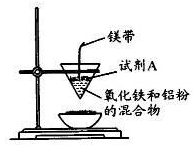
某学习小组设计如下实验方案,相关推测不合理的是

A.试管②滴入酚酞后溶液可能变浅红
B.试管③滴入FeCl3溶液后有红褐色沉淀生成
C.试管④中的变化是物理变化
D.上述反应说明Fe(OH)3溶解性小于Mg(OH)2
难度: 中等查看答案及解析
-
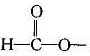
若NA表示阿伏加德罗常数的值,下列说法正确的是
A.2 .24 L NH3溶干1 L水中得到OH-数约为0.1NA
B.l 4 g N2与CO的混合气体含有的原于数目为NA
C.25℃时pH=13的NaOH溶液中含有OH- 的数目为0 .l NA
D.含l mol H2 SO4的浓硫酸与足量铜反应转移的电子为NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.丁烷的沸点高于丙醇
B.
与苯酚是同系物
C.淀粉、纤维素互为同分异构体
D.葡萄糖、果糖均能发生银镜反应
难度: 中等查看答案及解析
-
下图是某盐酸试剂标签部分内容,据此判断
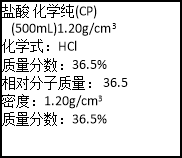
A.该盐酸与钠可存放在同一药品橱柜中
B.该盐酸含HCI质量为600 g
C.配制1OO mLO.2 mol/L盐酸需用到玻璃仪器为量筒、烧杯、玻璃棒
D.该盐酸的物质的量浓度为12. 0 mol/L
难度: 中等查看答案及解析
-
已知反应KClO3+6HCl = KCl+3Cl2↑+3 H2O,下列判断正确的是
A.KClO3 被氧化
B.氧化剂与还原剂之比为1:6
C.氧化产物是Cl2
D.HCl在化学反应中只能作还原剂
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
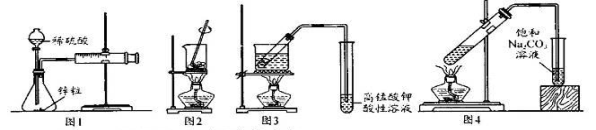
A.图1--测量锌与硫酸反应的速率
B.图2——灼烧海带成海带灰
C.图3——验证溴乙烷与NaOH乙醇溶液反应生成乙烯
D.图4——实骑室制备收集己酸乙酯
难度: 中等查看答案及解析
-
某软质隐形眼镜材料为如下图所币的聚合物。下列有关说法错误的是
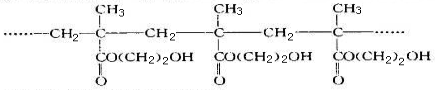
A.生成该聚合物的反应属加聚反应
B.该聚合物的单体是丙酸乙酯
C.i聚合物分子中存在大量的—OH,所以具有较好的亲水性
D.该聚合物的结构筒式为

难度: 中等查看答案及解析
-
化学与生活宙哪相关,下列用选、性质或变化对应正确的是
A.利用粮食酿酒的化学过程包含:淀粉一→葡萄糖一→己醇
B.在月饼包装袋中放人生石灰:防止食物氧化变质
C.焰火的绚丽:说明只有金属单质能发生焰色反应
D.氢氧化铝用于清疗胃酸过多:氢氧化锯碱性强
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能大量共存的是
A.c(Fe3+) =0.1mol·L-1的溶液中:K+、NH4+、SCN-、SO42-
B.水电离出的(OH-)=1。0×10-3 mol·L-1的溶液:Na+ 、K+、MnO4-、C2O42-
C.能与铝反应生成氢气的溶液中:K+、Cl- 、Na+、SiO32-
D.0 1 mol·L-1NaOH溶液K+、Na+、SiO32-、CO32-
难度: 中等查看答案及解析
-
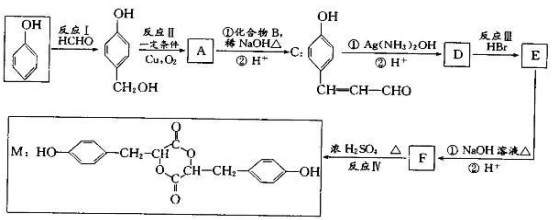
某有机物的结构为
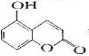 , ,下列有关说法正确的是
, ,下列有关说法正确的是 A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.钠与水反应:Na+2H2O=Na++OH-+H2↑
B.Kl溶液中滴入稀硫酸,空气中振荡:4H+ +41-+O2=2I2+2H2O
C.CuCl2溶液中加入氨水:Cu2+ +20H- = Cu(OH)2:↓
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
下列实验操作与现象均正确的是
选项
操作
现象
A
将铝片置于试管中,加入5mL浓硫酸
铝片无明显溶解
B
两试管各加入5mL 0.1 mol·L-1Na2S2O3溶液,同时分别滴入55mL 0.1 mol·L-1硫酸和盐酸
两只试管同时变浑浊
C
试管中加入2mL饱和Na2CO3溶液,滴入两滴酚酞,加热
溶液先变红,后红色变浅
D
向盛有1mL硫酸铜溶液的试管中逐滴加入氨水得到深蓝色溶液,然后加入乙醇
最终只能形成深蓝色透明溶液
难度: 中等查看答案及解析
-
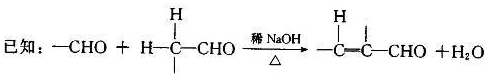
t℃时,在体积不变的容器中发生反应X(g)+3Y(g)
2Z(g)△H<O各组分浓度如下表
物质
X
Y
Z
初始浓度/ mol·L-1
0.1
0.3
0
2min末浓度/mol·L-1
0.08
平衡浓度/mol·L-1
0.1
下列说法不正确的是
A .0~2min的平均速率v(x) =0. 01 mol·L-1·min-1
B.达平衡时Y的转化率为50%
C.其它条件不变,升高温度,平衡逆向移动
D.其它条件不变,增加X的浓度,ν正增大
逆碱小,平衡正向移动
难度: 中等查看答案及解析
-
25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是
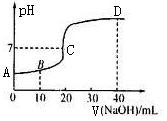
A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+)
B.B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-)
C.A点的纵坐标值为l
D.D点溶液2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—)
难度: 中等查看答案及解析
-
将等物质的量的铁和铜的混台物24 g与600mL稀硝酸恰好完全反应,生成NO6 .72 L(标准状况)向反应后的溶液中加入l mol·L-1 NaOH溶液使金属离于恰好沉淀,过滤。下列有关说法错误的是
A.混合物溶解后的溶液中 c(Fe3+): c(Fe2+) =1:1
B.需加入NaOH溶液1000mL
C.稀硝酸的物质的量浓度是2 mol·L-1
D.最后所得沉淀在空气中充分加热可得固体32 g
难度: 中等查看答案及解析