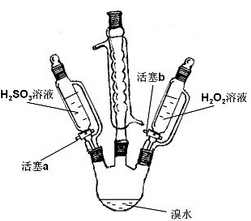
-
下表中对应关系错误的是
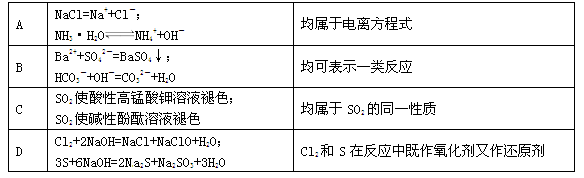
难度: 中等查看答案及解析
-
下列关于Fe2(SO4)3的叙述正确的是(设NA为阿伏加德罗常数的数值)
A.1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解)
B.1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子
C.在该溶液中,K+、NH4+、I-、SO42-可以大量共存
D.与Cu反应的离子方程式为:Fe3++Cu = Fe2+ + Cu2+
难度: 中等查看答案及解析
-
CO2中的一个O原子被S原子代替后,即为羰基硫(OCS),羰基硫是一种有臭鸡蛋气味的无色气体,高温下分解为CO和S。下列有关说法正确的是
A.OCS中S的化合价为+4价
B.羰基硫分解时,CO是氧化产物
C.每有1mol OCS分解,能生成22.4LCO
D.OCS中含有共价键,属于非电解质
难度: 中等查看答案及解析
-
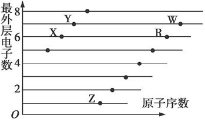
四种短周期元素在周期表中的相对位置如表所示,
下列说法正确的是
A.1个37W原子中,质子数比中子数多3个
B.Y和W处于同一主族,具有相同的最高价态
C.Z形成简单阴离子半径小于W形成简单阴离子半径
D.X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物
难度: 中等查看答案及解析
-
下列物质与足量铁反应,转移电子数最少的是
A.1mol氯气 B.1mol S
C.含1molHNO3的稀硝酸 D.含1molCuSO4的硫酸铜溶液
难度: 中等查看答案及解析
-
在化学中有很多规律,下列对规律的应用正确的是
A.根据较强酸可制取较弱酸的规律,可向次氯酸钠溶液中通入二氧化碳制取次氯酸
B.根据金属与盐溶液混合发生置换反应的规律,可用钠置换出硫酸铜溶液中的铜
C.根据酸性氧化物不与酸反应的规律,可用二氧化硅制成的容器盛放氢氟酸
D.根据电荷守恒规律,可判断溶液中所含阳离子数目一定等于阴离子数目
难度: 中等查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
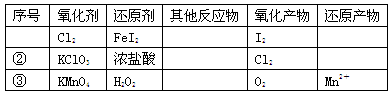
A.表中①组的反应中氧化产物一定是I2
B.氧化性强弱的比较:KClO3>Cl2>Fe3+>I2
C.表中②组每生成1molCl2,转移1mol电子
D.表中③组其他反应物可以为浓盐酸
难度: 中等查看答案及解析