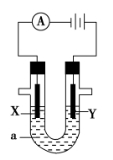
-
下列说法正确的是
A.升高温度或加入催化剂,可以改变化学反应的反应热
B.电解池是化学能转变成电能的装置
C.将碘酒滴在馒头上,可观察到馒头变蓝色
D.葡萄糖、淀粉、蛋白质均属于高分子化合物
难度: 简单查看答案及解析
-
下列物质之间的关系,错误的是:
A.CH3CH2OH和CH3OCH3互为同分异构体
B.干冰和冰为同一种物质
C.O2和O3互为同素异形体
D.CH3CH3和CH3CH2CH3互为同系物
难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是:
A.已知C(石墨,s)
C(金刚石,s) △H>0,说明金刚石比石墨稳定
B.已知H+(aq) + OH-(aq)
= H2O(l) △H= -57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ
C.已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g) + 2O2 (g) = CO2(g) + 2H2O(g) △H= -890.3kJ/mol
D.将0.5molN2和1.5molH2置于密闭容器中充分反应达到平衡时,放出热19.3kJ的热量,其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H= -38.6kJ/mol
难度: 简单查看答案及解析
-
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
平衡浓度/(mol·
L-1)
0.05
0.05
0.1
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增
大
D.改变温度可以改变此反应的平衡常数
难度: 简单查看答案及解析
-
某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是:
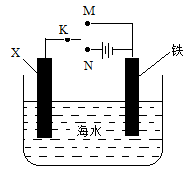
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处
B.若X为碳棒,开关K置于M处,会加快铁的腐蚀
C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e- =Fe3+
难度: 中等查看答案及解析
-
S-诱抗素的分子结构简式如图所示,下列关于该分子的说法正确的是:
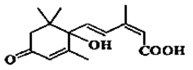
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
难度: 简单查看答案及解析
-
常温下,有下列四种溶液:
①
②
③
④
0.1 mol/L
NaOH溶液
pH = 11
NaOH溶液
0.1 mol/L CH3COOH溶液
pH = 3
CH3COOH溶液
下列说法正确的是:
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH<7,各离子浓
度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
难度: 简单查看答案及解析
-
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200 oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O, 电池示意如右图,下列说法不正确的是:
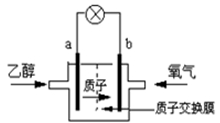
A.b极为电池的正极
B.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
C.电
池工作时电子由b极沿导线经灯泡再到a极
D.电池工作时,1mol乙醇被氧化时就有12mol电子转移
难度: 简单查看答案及解析
-
Ksp(AgCl)=1.56×10﹣10,Ksp(AgBr)=7.7×10﹣13,Ksp(Ag2CrO4)=9.0×10﹣12.某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010mol·L﹣1,向该溶液中逐滴加入0.010mol·L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为:
A.Cl﹣、Br﹣、CrO42﹣ B.CrO42﹣、Br﹣、Cl﹣ C.Br﹣、Cl﹣、CrO42﹣ D.Br﹣、CrO42﹣、Cl﹣
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是:
选项
操作
现象
解释或结论
A
测定等浓度的Na2CO3和Na2SO3溶液的pH
Na2CO3溶液的pH较大
非金属性C<S
B
向盛有2ml 0.1mol/L AgNO3溶液的试管中滴加一定量0.1mol/L NaCl溶液,再向其中滴加一定量
0.1mol/L KI溶液
先有白色沉淀生成,后又
产生黄色沉淀
Ksp(AgCl)> Ksp(AgI)
C
室温下,取相同大小、形状和质量的Cu粒分别投入0.1m
ol/L的稀硝酸和10.0mol/L的浓硝酸中
Cu粒与浓硝酸反应比与稀硝酸反应剧烈
探究浓度对化学反应速率的影响
D
用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合溶液
阴极上先析出铜
金属活动性:Mg>Cu
难度: 困难查看答案及解析
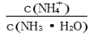 的值_________(填“增大”、“减小”或“不变”)。
的值_________(填“增大”、“减小”或“不变”)。