-
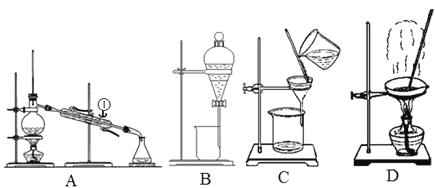
下列化学实验操作或事故处理方法错误的是
A. 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
B. 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸
C. 酒精灯着火时可用湿抹布盖灭
D. 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
难度: 简单查看答案及解析
-
以下是一些常用的危险品标志,装运汽油的包装应贴的图标是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列有关实验操作正确的是
A. 量取8.5mL液体
B. 称取10.05g氢氧化钠
C. 点燃酒精灯
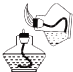 D. 加热液体
D. 加热液体
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是
A. 某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42-
B. 某溶液中加入NaOH溶液,生成蓝色沉淀,说明原溶液中含有Cu2+
C. 某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中含有Cl-
D. 某溶液中加入稀硫酸,产生无色气体,将气体通入澄清石灰水中生成白色沉淀,说明原溶液中含有CO32-
难度: 中等查看答案及解析
-
两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的
①原子总数 ②质子总数 ③分子总数 ④质量
A. ①② B. ②③ C. ①③ D. ②④
难度: 简单查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后下列正确的操作顺序是
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A. ①④①②⑤③ B. ①②⑤④①③ C. ①②④⑤③ D. ④②⑤
难度: 困难查看答案及解析
-
下列有关物质的分类正确的是( )
A.氯化钡、四氯化碳、硫酸、碘酒都属于化合物
B.硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物
C.溶液、浊液、胶体、空气都属于混合物
D.CO2、SO2、P2O5、CO都属于酸性氧化物
难度: 中等查看答案及解析
-
在某无色透明的强碱性溶液中,能大量共存的离子组是
A. Na+、K+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na2+、K+、Cl-、SO42- D. NH4+、K+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列各组中物质间的反应,不能用同一离子方程式来表示的是
A. 盐酸与碳酸钠溶液;稀硫酸与碳酸钾溶液
B. 铁与盐酸;铁与稀硫酸
C. 硫酸铜溶液与氢氧化钠溶液;硫酸铜与氢氧化钡溶液
D. 氢氧化钠溶液与稀硫酸;氢氧化钾与稀硝酸
难度: 困难查看答案及解析
-
等质量的①CH4、②H2、③HC1、④SO2四种气体,在标准状况下体积由大到小的顺序是
A. ②>①>③>④ B. ④>③>①>② C. ③>②>④>① D. ①>④>②>③
难度: 简单查看答案及解析
-
已知某饱和NaCl溶液的体积为VmL,密度为ρg/cm3,质量分数为w%,物质的量浓度为cmol/L,溶液中含NaCl的质量为mg。则下列表达式正确的是
A. n(NaCl)=ρV/58.5 B. c(NaCl)=10ρw/58.5 C. w=m/ρV D. V=22.4m/58.5
难度: 困难查看答案及解析
-
有a、b、c、d 四瓶无色溶液,它们分别是Ba(OH)2溶液,NaHCO3溶液、MgCl2溶液、稀硫酸中的某一种。现各取少量溶液进行两两混合,实验现象如下表所示,表中“↓”表示生成沉淀;“↑”表示生成气体;“一”表示无明显现象。下列推理不正确的是
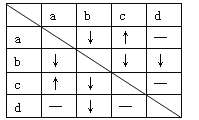
A. c一定是稀硫酸 B. d一定是MgCl2溶液
C. a可能是NaHCO3溶液 D. b一定是Ba(OH)2溶液。
难度: 困难查看答案及解析