-
下列化学用语正确的是
A.白磷的分子式:P B.Na+结构示意图是:
C.碳一12 的原子符号:612C D.HClO的电子式:
难度: 中等查看答案及解析
-
下列叙述正确的是
A.有单质参加或单质生成的化学反应一定是氧化还原反应
B.有阳离子存在的物质中一定存在阴离子
C.只有一种生成物的化学反应不一定是化合反应
D.离子反应一定是复分解反应
难度: 中等查看答案及解析
-
实验是研究化学的基础,下图所示的实验方法、装置或操作完全正确的是
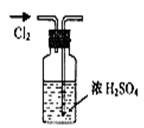
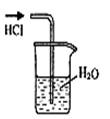
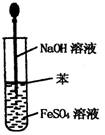
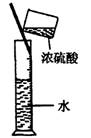
A.干燥Cl2 B.吸收NH3 C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
难度: 中等查看答案及解析
-
当反应条件或反应物浓度改变时,下列物质间反应所得的产物不会发生改变的是
A.铁和盐酸 B.钠和氧气 C.铝和硫酸 D.铜和硝酸
难度: 中等查看答案及解析
-
能实现下列物质间直接转化的元素是
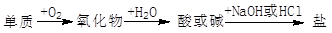
A.硅 B.硫 C.铜 D.铁
难度: 中等查看答案及解析
-
R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定不正确的是
A.原子半径:R>Q B.R和Q可形成离子化合物RQ
C.R和Q可形成共价化合物RQ2 D.R和Q可形成共价化合物RQ3
难度: 中等查看答案及解析
-
根据下列实验事实,得出的结论正确的是

难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.23gNa在氧气中完全燃烧失电子数为0.5NA
B.1L 2mol·L-1的MgCl2溶液中含Mg2+数为2NA
C.标准状况下,11.2LSO3所含分子数为0.5NA
D.室温下,8g甲烷含有共价键数为2NA
难度: 中等查看答案及解析
-
下列各组物质中,前一种物质与后两种物质反应后不能产生同一气体的是
A.Al(NaOH溶液、盐酸) B.(NH4)2S(NaOH溶液、盐酸)
C.H2O(Na2O2、F2) D.NaHCO3(AlCl3溶液、盐酸)
难度: 中等查看答案及解析
-
下列事实能判断金属元素甲的金属性一定比乙强的有
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤等物质的量的两单质分别与氯气反应时生成阳离子时,甲失去的电子数比乙多
A.全部可以 B.仅②不可以 C.仅②⑤不可以 D.③④可以
难度: 中等查看答案及解析
-
下列说法不正确的是
①鉴别NO2和溴蒸气,可以使用湿润的淀粉KI试纸。
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺
些小孔,然后按入水中,两者放出的氢气质量相等
A.①②④ B.①②③ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Ca(ClO)2溶液中通入过量CO2:Ca2++2C1O-+H2O+CO2 CaCO3↓+2HC1O
B.Ba(OH)2溶液中滴入NaHSO4溶液至恰好为中性:
2H++SO42-+Ba2++2OH- BaSO4↓+2H2O
C.金属钠投入水中:2Na+H2O===2Na++OH-+H2↑
D.NaOH溶液中通入C12:2C12+2OH- 3C1-+C1O-+H2O
难度: 中等查看答案及解析
-
把少量CO2分别通入到浓度相同的:①Ba(NO3)2溶液;②Ba(OH)2溶液;③溶有氨的BaCl2溶液中。能观察到白色沉淀的溶液是
A.只有② B.②和③ C.①和② D.③
难度: 中等查看答案及解析
-
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
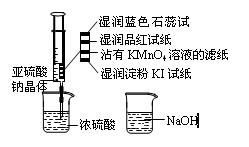
则下列有关说法正确的是
A.湿润的淀粉KI试纸未变蓝说明SO2的氧化性
弱于I2
B.沾有KMnO4溶液滤纸、湿润的品红试纸均褪色证明了SO2漂白性
C.湿润的蓝色石蕊试纸先变红后褪色
D.NaOH溶液可用于除去实验中多余的SO2
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是
A.所得溶液呈无色 B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生 D.最后得到的溶液中可能含有Fe3+
难度: 中等查看答案及解析
-
由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20,下列说法中正确的是
A.晶体中阳离子和阴离子个数一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期
D.晶体中阳离子半径一定大于阴离子半径
难度: 中等查看答案及解析
-
向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是

难度: 中等查看答案及解析
-
1.6g Cu与50mL 8mol·L—1的HNO3溶液充分反应,HNO3的还原产物有NO和NO2,反应后测得溶液中H+浓度为a mol·L—1(生成水的体积忽略不计),则此时溶液中所含NO3-的物质的量为
A.(a+1)mol B.(0.4+0.05a)mol C.(a+0.05)mol D. 0.05(a+1)mol
难度: 中等查看答案及解析
 上图中的E和F构成量气装置,用来测定O2的体积。
上图中的E和F构成量气装置,用来测定O2的体积。