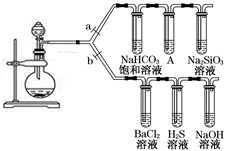
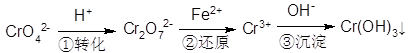-
下列有关物质性质与用途具有对应关系的是
A. Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 中等查看答案及解析
-
化学与生产、生活、环境等息息相关,下列有关说法中正确的是( )
A. SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
B. 工业上生产玻璃、水泥均需要用石灰石为原料
C. 食品袋中常放有硅胶和铁粉,都能起到干燥的作用
D. 燃煤中加入CaO能可以减少酸雨的形成及温室气体的排放
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1mol Na2O和Na2O2的混合物中含有的阴离子总数大于6.02×1023
B. 1mol•L-1的Na2SO4溶液中,含Na+的个数为2NA
C. 标准状况下,2.24L CCl4所含的原子数为0.5NA
D. 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,可能大量共存的是( )
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 无色透明的溶液中: Fe3+、Mg2+、SCN –、Cl –
C. pH=1的溶液中:SO42—、K+、Na+、S2O32-
D. 使石蕊变红的溶液中:Fe2+、K+、NO3-、SO42-
难度: 中等查看答案及解析
-
NaH(氢化钠)是一种离子化合物,其中钠是+1价,NaH和水反应:2NaH+H2O= 2NaOH+H2↑。下列叙述正确的是( )
A. 在上述反应中NaH是氧化剂
B. 在上述反应中NaOH是氧化产物
C. NaH中氢离子(H-)半径比锂离子半径小
D. NaH中氢离子的电子层排布与氦原子相同
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 氯气与水反应:Cl2 + H2O =2H+ + Cl— + ClO—
B. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. 过量的铁与稀硝酸反应的离子方程式为3Fe+8H++2NO3-═3 Fe2++2NO↑+4H2O
D. 次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
难度: 中等查看答案及解析
-
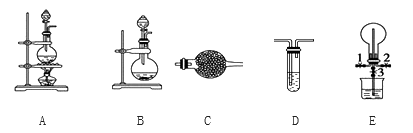
下列有关叙述不正确的是( )
A. 不能用酒精萃取碘水中的碘
B. 配制一定物质的量浓度溶液定容时,俯视容量瓶刻度线会使溶液浓度偏高
C. 测氯水的pH时,可用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D. 中和热测定实验中,用铜质搅拌棒代替玻璃搅拌棒会导致所测定的热量偏低
难度: 中等查看答案及解析
-
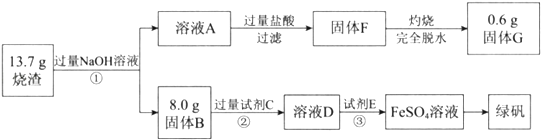
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
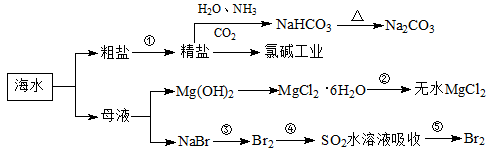
A. 制取NaHCO3的反应是利用其溶解度小于NaCl
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
下列制备单质的方法中,需要加入还原剂才能实现的是( )
A. 高炉炼铁 B. 电解法制金属镁
C. 加热氧化汞制金属汞 D. 从海带灰浸取液中(含I-)提取碘单质
难度: 简单查看答案及解析
-
下列现象或事实能够用相同的原理解释的是
A. NaOH、FeSO4在空气中放置变质
B. 氯水、AgI密封保存在棕色试剂瓶中
C. SO2使品红和酸性KMnO4溶液褪色
D. 常温下浓硝酸不能溶解Al和Au(金)
难度: 简单查看答案及解析
-
根据原子结构、元素周期表和元素周期律,判断下列叙述不正确的是( )
A. 元素钇的一种核素
的质子数与中子数之差为21
B. 气态氢化物的稳定性:H2O>NH3>SiH4
C. 同主族元素从上到下,单质的熔点逐渐降低
D. 用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析
-
室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是
A. 0.1 mol/L的盐酸15mL B. 0.15 mol/L的硫酸溶液8mL
C. 0.4 mol/L的硝酸12mL D. 18 mol/L的浓硫酸15mL
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有SO42-
B. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
C. 灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
D. 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 500 ℃,30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ·mol-1
D. 已知2C(s)+2O2(g)===2CO2(g) ΔH1 ; 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
将一定量的锌放入200mLl8.4mol/L浓硫酸中加热,充分反应后锌完全溶解,同时生成气体X 44.8L(标准状况)。将反应后的溶液稀释至0.8L,测得溶液c(H+)=0.2mol/L,则下列判断错误的是
A. 气体X为SO2和H2的混合物 B. 反应中共转移4mol电子
C. 气体X中SO2与H2的体积比为1:4 D. 反应中共消耗Zn 130 g
难度: 困难查看答案及解析
-
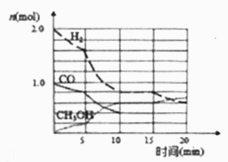
在密闭容器中,反应X2(g)+Y2(g)
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )

A. 图Ⅰ是充入入少量X2的变化情况 B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是改变压强的变化情况 D. 图Ⅲ是改变温度的变化情况
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸做氧化剂
B. NH4CuSO3中硫元素被氧化
C. 1 mol NH4CuSO3完全反应转移0.5 mol电子
D. 刺激性气味的气体是氨气
难度: 中等查看答案及解析
-
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
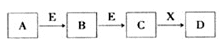
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或 C
难度: 中等查看答案及解析