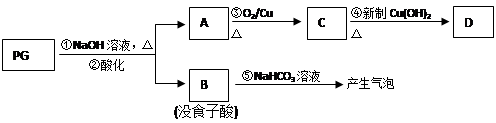-
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
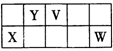
(1)W的原子结构示意图为________;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为________;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:
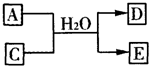
若E为白色沉淀,则E物质的化学式为________;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n]________(填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a________b(填“>"或“<”或“=”)。
-
汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为________。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。
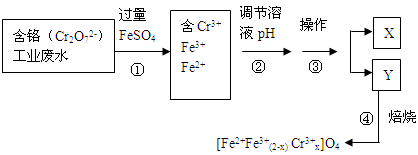
(2)加过量FeSO4的目的是________。
(3)配平步骤①的反应的离子方程式________Fe2++ ________Cr2O72—+_____== ________Fe3++ ________Cr3++________H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
| 样品序号 | 取样深度(m) | 有机质(×10—2g) | 总铬(×10—6g) |
| 样品A-1 | 0.00 ~ 0.30 | 2.81 | 114 |
| 样品A-2 | 0.30 ~ 0.60 | 1.72 | 111 |
| 样品A-3 | 1.20 ~ 1.80 | 1.00 | 88 |
| 样品B-1 | 0.00 ~ 0.30 | 2.60 | 116 |
| 样品B-2 | 0.30 ~ 0.60 | 2.48 | 112 |
| 样品B-3 | 1.20 ~ 1.80 | 1.83 | 106 |
从表中你可以得出的结论有(答一点即可)。
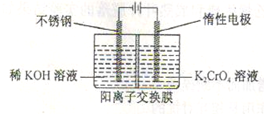
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由________变为________。原因是________。
Cr2O72-(橙色)+H2O通电后阳极区溶液由________变为________。原因是________。
-
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是________。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 |
| I3 | 3248 | 2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是________。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。 某镍配合物结构如图所示,分子内含有的作用力有________(填序号)。

A氢键;B离子键;C共价键;D金属键;E配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
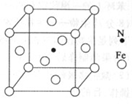
(6)铁能与氮形成一种磁性材料,其晶胞结构如图所示,则该磁性材料的化学式为 ________。
-
没食子酸丙酯简称PG,结构简式为 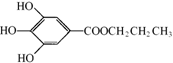 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
(1)PG的分子式为________,请写出PG分子中所含官能团的名称________,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是________。
PG可发生如下转化:
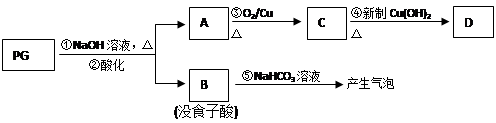
(2)A的结构简式为 ________,1mol没食子酸最多可与________mol H2 加成。
(3)上图的有关变化中,属于氧化反应的有(填序号)________。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号)________。
a.含有苯环 b.含有羧基 c.含有酚羟基 d. 微溶于食用油
(5)反应④的化学方程式为: ________
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:________
i.含有苯环,且苯环上的一溴代物只有一种;ii.既能发生银镜反应,又能发生水解反应。
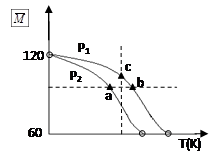
2CH3COOH (g),经实验测得不同压强下,体系的平均摩尔质量(
=
)随温度(T)的变化曲线如图所示,下列说法正确的是





 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。