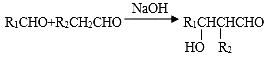-
化学与生活密切相关。下列有关说法错误的是
A. SO2和NO2是主要的大气污染物
B. 大气中的SO2和CO2溶于水形成酸雨
C. 以液化石油气代替燃油可减少大气污染
D. 对煤燃烧后形成的烟气脱硫,目前主要用石灰法
难度: 中等查看答案及解析
-
下列化学变化属于取代反应的是
A. 甲烷在空气中完全燃烧 B. 在镍做催化剂的条件下,苯与氢气反应
C. 乙烯通入溴水中 D. 乙醇与乙酸制备乙酸乙酯
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b与a可形成多种有机化合物,c的单质是构成空气的主要成分,d元素的焰色反应呈黄色。下列叙述错误的是
A. 简单离子半径:c>d
B. a、b、c、d中,d的原子半径最大
C. a与b、c形成的化合物可能含有非极性键
D. a与其它元素形成的化合物均为共价化合物
难度: 中等查看答案及解析
-
分子式为C4H8ClBr的有机物共有(不含立体异构)
A. 9种 B. 10种 C. 11种 D. 12种
难度: 困难查看答案及解析
-
“可呼吸”钠-二氧化碳电池的工作原理为4Na+3CO2
2Na2CO3+C。下列叙述错误的是
A. 放电时,Na+由负极向正极移动
B. 充电时,阴极反应式为Na++ e—= Na
C. 电解质溶液可选NaClO4水溶液
D. 电池放电时把二氧化碳变废为宝,有重要的研发意义
难度: 中等查看答案及解析
-
下列除杂方法错误的是
括号内为杂质
实验操作或方法
A.
NO2(NO)
通入O2
B
CuSO4溶液[Fe2(SO4)3]
加入足量CuO,过滤
C
溴苯(溴)
加入NaOH溶液,分液
D
MnO2(I2)
加热
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
①第一份加足量NaOH溶液加热后,收集到气体0.05 mol;
②第二份加足量BaCl2溶液后,得干燥沉淀4.3 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。下列说法正确的是
A. K+一定存在
B. 溶液中c(Cl-)可能为0.2 mol/L
C. Cl-可能存在
D. Ba2+一定不存在,Mg2+可能存在
难度: 困难查看答案及解析
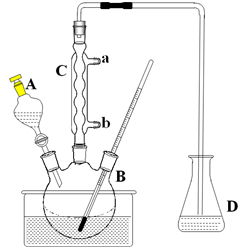
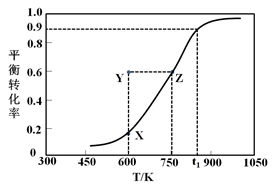
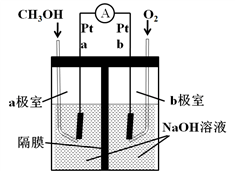
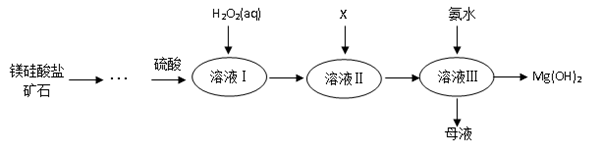
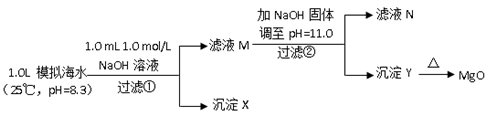
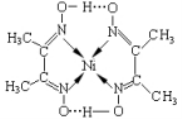
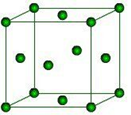
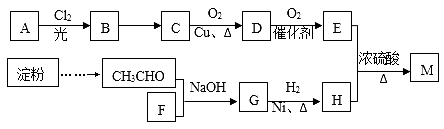 已知:
已知: