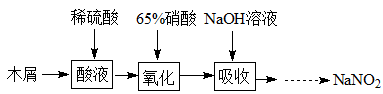
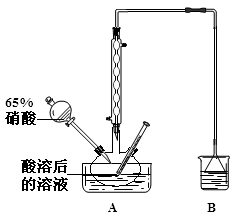
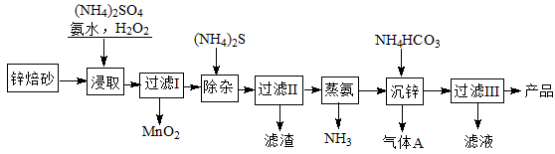
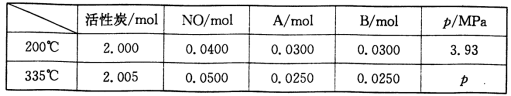
-
为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》。下列做法有利于该目标实现的是( )
A.推广使用含磷洗涤剂
B.用O3替代Cl2作饮用水消毒剂
C.用工业污水直接灌溉农田
D.含H2SO4的废水用BaCl2处理后排放
难度: 简单查看答案及解析
-
甲、
乙、丙、X是中学化学中常见的4种物质,其转化关系符合下图。其中甲和X可能是( )

A.甲为Fe、X为Cl2
B.甲为S、X为O2
C.甲为SO2、X为NaOH溶液
D.甲为AlCl3溶液、X为NH3·H2O
难度: 中等查看答案及解析
-
2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:下列说法正确的是( )
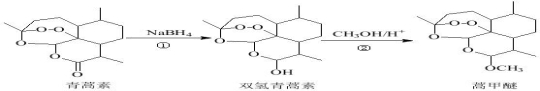
A.①、②反应依次为还原反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向0.1molFeI2溶液中滴加少量
氯水,反应中有0.3NA电子转移
B.向溴水中加入足量氯化亚铁能使溶液变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
难度: 困难查看答案及解析
-
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是 ( )
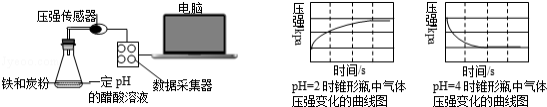
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
难度: 困难查看答案及解析
-
有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是 ( )
A.若B(OH)m 是强碱,则A(OH)m一定为强碱
B.若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸
C.若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属
D
.若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性
难度: 中等查看答案及解析
-
AlPO4的沉淀溶解平衡曲线如图所示(T2>T1。下列说法正确的是( )
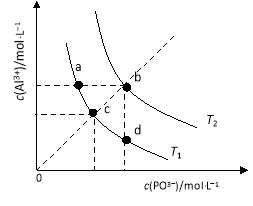
A.图像中四个点的Ksp:a=b>c>
d
B.AlPO4在b点对应的溶解度大于c点
C.AlPO4(s)
Al3+(aq)+PO43(aq) △H<0
D.升高温度可使d点移动到b点
难度: 中等查看答案及解析