-
亚硝酸钠可大量用于染料和有机合成工业。请回答下列问题:
(1)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种活性气体,该气体在空气中迅速变色。写出反应的离子方程式 。
(2)实验室模拟用如图所示装置通过如下过程制备亚硝酸钠:
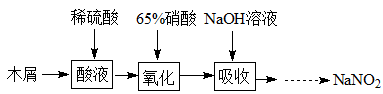
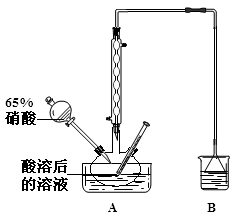
已知:(I)氧化过程中,控制反应液的温度在35~60℃条件下发生的主要反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氢氧化钠溶液吸收NO、NO2发生如下反应:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反应温度不宜高于60℃,原因是 。
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH外还有两种阴离子,其中一种是NO2,NO2与另一种阴离子的物质的量之比为 。
③B装置用于制备NaNO2,盛装的试剂除NaOH外,还可以是 。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3(aq)
(3)测定产品纯度:
I.准确称量ag产品配成100 mL溶液;
II.从步骤I配制的溶液中移取20.00 mL加入锥形瓶中;
III.用c mol·L1酸性KMnO4溶液滴定至终点;
IV.重复以上操作3次,消耗KMnO4酸性溶液的平均体 积为V mL。
积为V mL。
①锥形瓶中发生反应的离子方程式为 。
②滴定至终点的现象为 。
③ 产品中NaNO2的纯度为 (写出计算表达式)。
产品中NaNO2的纯度为 (写出计算表达式)。
④若滴定终点时俯视读数,则测得的产品中NaNO2的纯度 (填“偏高”、“偏低”或“无影响”)
-
(15分)亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:
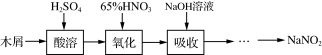
已知氧化过程中,控制反应液的温度在55~60℃条件下发生的主要反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)酸溶过程中,硫酸的作用是_________。吸收完成后,将吸收液蒸发浓缩、________、________(填操作名称)、洗涤得到白色晶状的亚硝酸钠。
(2)实验室模拟氧化和吸收过程的装置如图所示,A装置须控制反应液的温度不高于60℃的原因是____;B装置用于制备亚硝酸钠,其中盛放的溶液是________(填字母)。
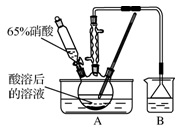
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1∶1。若(NO)∶n(NO2)>1∶1,则会导致________;若n(NO)∶n(NO2)<1∶1会使产品中混有的杂质为________。
(4)已知NaNO2能把酸性条件下的Fe2+氧化,同时产生一种有毒的气体,请写出该反应的离子方程式:________________________________。
(5)已知:①NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O32-又能把I2还原为I-。②NaNO2也有还原性,能使酸性KMnO4溶液褪色。
为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,________。
实验中可供选择的试剂:稀硫酸、c1 mol·L-1 KI溶液、淀粉溶液、c2 mol·L-1 Na2S2O3溶液、c3 mol·L-1酸性KMnO4溶液。
-
亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
______NaNO2 + _______KI + _______ _______NO +______I2 +______K2SO4 +______Na2SO4+_______
_______NO +______I2 +______K2SO4 +______Na2SO4+_______
(1)请完成该化学方程式并配平。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了_______________个。
(3)现有25.00 mL的KI溶液,用酸化的10.00 mL 0.0500 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.00 mL。求剩余的KIO3为 mol,原KI溶液的物质的量浓度是 mol/L
-
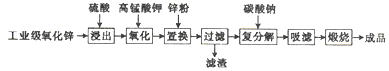
高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

回答下列问题:
(1)浸出时,为了提高浸出效率采取的措施有(写两种):__________;
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn元素全 部转化为MnO2),请配平下列除去Fe2+的离子方程式:
______MnO4-+______Fe2++_____=______MnO2↓+______Fe(OH)3↓+______H+
(3)加入锌粉的目的是_____________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04mg/L、c(Mn2+) ="1." 65mg/L。
①加入KMnO4溶液反应一段时间后,溶液中c(Fe3+) ="0." 56 mg/L,若溶液pH=3,则此时Fe3+_________(填“能”或“不能”)发生沉淀。
②若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入________g KMnO4。
-
高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
回答下列问题:
(1)浸出时,为了提高浸出效率采取的措施有(写两种):__________;
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn元素全 部转化为MnO2),请配平下列除去Fe2+的离子方程式:
______MnO4-+______Fe2++_____=______MnO2↓+______Fe(OH)3↓+______H+
(3)加入锌粉的目的是_____________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04mg/L、c(Mn2+) =1. 65mg/L。
①加入KMnO4溶液反应一段时间后,溶液中c(Fe3+) =0. 56 mg/L,若溶液pH=3,则此时Fe3+_________(填“能”或“不能”)发生沉淀。
②若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入________g KMnO4。
-
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
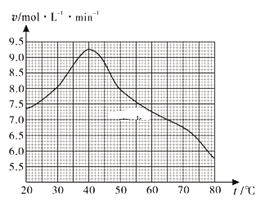
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______,所得溶液的物质的量浓度为______。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________。
-
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:
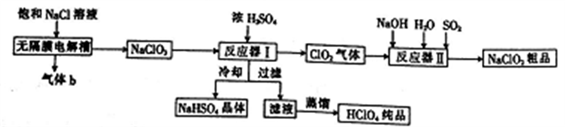
已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中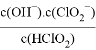 =__________。
=__________。
-
下列有关物质的性质或应用均正确的是
A.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
B.二氧化硅为酸性氧化物,可用于制作计算机芯片
C.碳酸钠可以作为食品疏松剂
D.硫酸铜溶于水呈酸性,可用来做杀菌剂
-
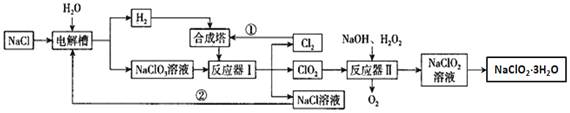
亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:
请回答下列问题:
为了测定NaClO2 ·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。
-
亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:

请回答下列问题:
(1)合成塔中生成的物质是___(填化学式);
(2)电解槽中阳极上的电极反应式为___;
(3)反应器Ⅰ中发生反应的化学方程式为___;反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为___;
(4)流程中①、②在工业生产中的现实意义是___;
(5)从NaClO2溶液中得到NaClO2·3H2O粗晶体的步骤为___、___,过滤、洗涤干燥;
(6)为了测定NaClO2 ·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。


积为V mL。
产品中NaNO2的纯度为 (写出计算表达式)。






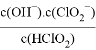 =__________。
=__________。
