-
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是 ( )
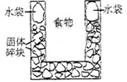
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
难度: 简单查看答案及解析
-
反应4A(g)+5B(g)
4C(g)+6D(g)在0.50 L密闭容器中进行,半分 钟后,A减少了0.90 mol,则此反应的平均速率可以表示为 ( )
A. v(A)=3.6 mol·L-1·s-1 B. v(B)=0.075 mol·L-1·s-1
C. v(C)=0.030 mol·L-1·s-1 D. v(D)=0.060 mol·L-1·s-1
难度: 简单查看答案及解析
-
1 g正丁烷(C4H10)燃烧生成CO2和液态水,放出49.6 kJ热量,则其热化学方程式为( )
A. 2C4H10+13O2 == 8CO2+10H2O ΔH=-5 753.6 kJ·mol-1
B. C4H10(g)+13/2 O2(g)==4CO2(g)+5H2O(g) ΔH=-2 876.8 kJ·mol-1
C. 2C4H10(g)+13O2(g)==8CO2(g)+10H2O(l) ΔH=-2 876.8 kJ·mol-1
D. C4H10(g)+13/2 O2(g)==4CO2(g)+5H2O(l) ΔH=-2 876.8 kJ·mol-1
难度: 简单查看答案及解析
-
对于同温同压下可逆反应 2A(g) + B(s)
C(g)+D(g)达到平衡的标志是( )
A.压强不变 B.每分钟A的减少量等于D的增加量的两倍
C.B物质的浓度不变 D.A物质的百分含量不变
难度: 简单查看答案及解析
-
(原创题)下列物质中,其水溶液能导电溶于水时化学键被破坏的非电解质是( )
A.盐酸 B.硫酸钡 C.乙醇 D.二氧化硫
难度: 简单查看答案及解析
-
(改编题)下列能用勒夏特列原理解释的是 ( )
①红棕色NO2加压后颜色先变深后变浅 ②实验室中常用排饱和食盐水的方式收集氯气 ③Fe(SCN)3溶液中加入固体KSCN后颜色变深 ④氯水宜保存在低温、避光条件下 ⑤合成氨反应,为提高氨的产率,理论上应采取降低温度的措施⑥ SO2催化氧化成SO3的反应,往往加入过量的空气⑦工业制取金属钾Na(l) + KCl(l)
NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
A.①③⑤⑥⑦ B.②④⑤⑥⑦ C.①②④⑤⑥ D.全部
难度: 简单查看答案及解析
-
在一定温度不同压强(P1<P2)下,可逆反应2X(g)
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如以下图示,正确的是 ( )

难度: 简单查看答案及解析
-
(原创题)某温度下,反应2NO2(g)
N2O4(g) ΔH<0在密闭容器中达到平衡,下列叙述中正确的是 ( )
A.保持体积不变,加入少许NO2,再达平衡时NO2的体积分数变小
B.保持体积不变,加入少许NO2,将使逆反应速率减小
C.加压使体积变小,将使逆反应速率增大,平衡时颜色变浅
D.保持体积不变,升高温度,再达到平衡时颜色加浅
难度: 简单查看答案及解析
-
(改编题)在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是 ( )
A. m + n>p B. 平衡向正反应方向移动
C. A的转化率降低 D. C的体积分数增加
难度: 简单查看答案及解析
-
在一固定容积的密闭容器中,充入2molA和1molB发生反应:2A(g)+B(g)
x C(g),达到平衡后, 达到平衡时,C的物质的量浓度为0.9mol/L。若维持容器体积和温度不变,按0.6 molA, 0.3molB和1.4 molC为起始物质,达到平衡后,C的物质的量浓度也为0.9mol/L,则x的值为 ( )
A. 只能为2 B. 只能为3 C. 只能为4 D. 可能为2或3
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. NH4NO3 溶于水虽然吸热,但其溶于水是自发过程
B. 过热液体(温度高于沸点)会自发转变成气体,可用焓变解释。
C. 对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最大
D.有序火柴散落的自发过程可用能量判据解释
难度: 简单查看答案及解析
-
已知反应mX(g)+nY(g)
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( B )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
难度: 简单查看答案及解析
-
现有X(g)+Y(g)
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的( )
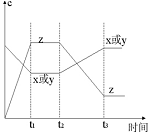
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
难度: 简单查看答案及解析
-
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用的方法是( )
A.加热 B.加入1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸 D.加入少量的1mol/L 的NaOH溶液
难度: 简单查看答案及解析
-
(原创题)25℃时,水的电离平衡:H2O
H++OH— △H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH—)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体NaOH,平衡逆向移动,c(OH—)降低
D. 将水加热,Kw增大,c(H+)不变
难度: 简单查看答案及解析
-
体积相同的甲、乙两容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:
2SO2 + O2
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器内SO2的转化率为P%,则乙容器中SO2的转化率( )
A、等于P% B、大于P% C、小于P% D、无法判断
难度: 简单查看答案及解析
